|
МЕТАБОЛИЧЕСКИЕ И АНТИОКСИДАНТНЫЕ СВОЙСТВА ТЕСТОСТЕРОН-ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ ПРИ СОЧЕТАНИИ САХАРНОГО ДИАБЕТА 2-го ТИПА И МУЖСКОГО ГИПОГОНАДИЗМАДата: 01.08.2017 Источник: Сахарный диабет 2 типа. Проблемы и решения. Том 6. Глава 3. Участники: Аметов А.С., Камынина Л.Л., Рождественская О.А., Литвиненко В.М. вернуться к медиатеке скачать интервью в docx формате скачать интервью в txt формате скачать интервью в pdf формате  Глава 3. МЕТАБОЛИЧЕСКИЕ И АНТИОКСИДАНТНЫЕ СВОЙСТВА ТЕСТОСТЕРОН-ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ ПРИ СОЧЕТАНИИ САХАРНОГО ДИАБЕТА 2-го ТИПА И МУЖСКОГО ГИПОГОНАДИЗМА Аметов А.С., Камынина Л.Л., Рождественская О.А., Литвиненко В.М. Гендерный аспект в управлении СД 2-го типа предполагает достижение не только целевых значений метаболического контроля, но и поддержание высокого качества мужского здоровья. При современном рассмотрении патогенетического механизма развития СД 2-го типа и мужского гипогонадизма выявляется их глубинная взаимосвязь. Так, ключевым звеном прогрессирования СД 2-го типа является развитие окислительного стресса, усиливающегося при повышении вариабельности гликемии. Образование избыточного количества свободных радикалов кислорода определяет формирование плохой гликемической памяти, интенсивность процесса перекисного окисления липидов и развитие эндотелиальной дисфункции. Между тем вследствие влияния окислительного стресса на синтез тестостерона и эректильную дисфункцию, данный процесс способствует и прогрессированию мужского гипогонадизма. Кроме того, избыток висцерального жира вызывает нарушение адипокинового ответа и предрасполагает к снижению уровня тестостерона. Установлено, что коррекция мужского гипогонадизма ассоциируется с улучшением метаболических характеристик углеводного и липидного ответа. В настоящее время наряду с прямым влиянием тестостерона на функциональное состояние гипоталамо-гипофизарно-тестикулярной оси учитываются и его антиоксидантные свойства, позволяющие внести вклад в устранение негативного эффекта свободных радикалов активного кислорода в условиях окислительного стресса при СД 2-го типа. МЕТАБОЛИЧЕСКИЕ СВОЙСТВА ТЕСТОСТЕРОНА Подтвержденная в настоящее время неразрывная патогенетическая связь между мужским гипогонадизмом и висцеральным ожирением позволяет рассматривать мужской гипогонадизм в качестве одного из компонентов метаболического синдрома. У пациентов с СД 2-го типа мужской гипогонадизм и висцеральное ожирение рассматриваются как модифицируемые факторы ухудшения гликемического и негликемического контроля. Показано, что распространенность мужского гипогонадизма у пациентов с СД и висцеральным ожирением составляет 51% [1]. При этом при отсутствии коррекции гипогонадизма отмечается прогрессивное ухудшение качества гликемического контроля, развитие сердечно-сосудистых заболеваний, мужского остеопороза и повышение смертности [2]. Висцеральное ожирение, ассоциированное с развитием СД 2-го типа, затрудняет достижение терапевтического эффекта вследствие развития глюкозолипотоксичности [3]. Увеличение депо висцерального жира изменяет также нормальную секрецию адипокинов и сопровождается развитием состояний лептинорезистентности и гипоадипонектинемии. Кроме того, акцентируется внимание на «диабетической дислипидемии», компонентами которой являются гипертриглицеридемия, повышение уровня ЛПНП и снижение уровня ЛПВП. Метаболический эффект тестостерона характеризуется влиянием на инсулинорезистентность, гомеостаз глюкозы и липидный обмен (рис. 3.1). Действие тестостерона ассоциируется с повышением экспрессии инсулинового рецептора, мембранного транспортера глюкозы GLUT4, субстрата инсулинового рецептора IRS и повышает интенсивность процесса фосфорилирования [4]. Рассматривая влияние тестостерона на липидный обмен, следует отметить обнаружение статистически достоверно значимой корреляции между уровнем тестостерона и составом тела. При этом мужской гипогонадизм ассоциируется с увеличением депо абдоминального жира и развитием висцерального ожирения [5]. Кроме того, установлено взаимодействие между гипота-ламо-гипофизарно-тестикулярной осью, гипоталамическими центрами аппетита-насыщения и жировой тканью. Показано, что в условиях инсулинорезистентности инсулин, периферический гипоталамический регулятор, вызывает супрессию грелин-индуцированного сигнального пути кальция в нейронах аркуатных ядер гипоталамуса, вырабатывающих нейропептид Y, и, соответственно, усиление синтеза нейропептида Y, способствующего набору массы тела [7]. При этом инсулинорезистентость на уровне гипоталамуса способствует снижению уровня лютеинизирующего гормона (ЛГ), что также вносит вклад в снижение уровня тестостерона. Между тем продемонстрировано, что периферический эффект инсулина в клетках Лейдига опосредует нарушение процесса стероидогенеза и снижение синтеза тестостерона (рис. 3.2). 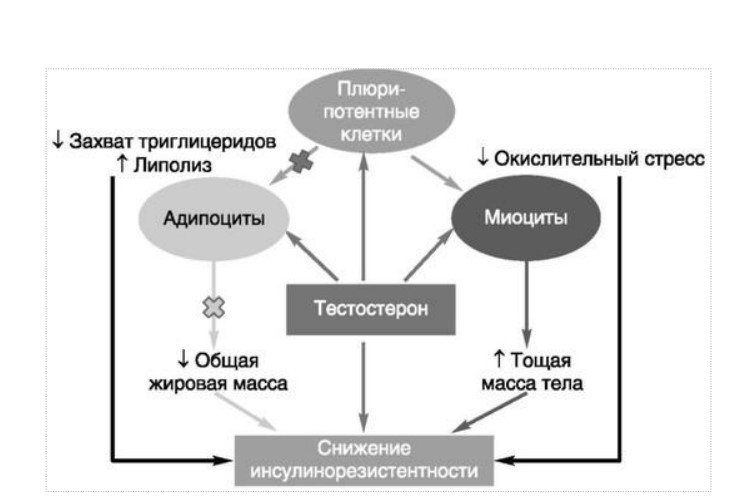 2Рис. 3.1. Положительный эффект тестостерона на метаболизм углеводов, липидов и окислительный стресс. Адаптировано согласно Grossmann M. [6] Между тем в клетках, синтезирующих стероиды, к которым относятся и клетки Лейдига, митохондрии являются ключевым регулятором стероидогенеза. При этом в условиях стресса как адаптивной реакции организма происходит активация гипоталамо-гипофизарно-надпочечниковой оси и супрессия гипоталамо-гипофизарно-тестикулярной. Установлено, что митохондриальный стероидогенез - это многоступенчатый процесс, характеризующийся сложным взаимодействием с другими клеточными и молекулярными структурами, особенно в период повышенной энергетической потребности организма. Так, ядерно-митохондриальное взаимодействие опосредовано вовлечением в процесс транскрипционных факторов - ядерных респираторных факторов NRF1 и NRF2, транскрипционного фактора PRARγ, α-изоформы рецепторов эстрогенов ERRα, фактора, связывающего cAMP-респонсивный элемент CRE, и многими другими. Между тем еще предстоит установить вклад семейства рецепторов, активируемых пероксисомными пролифераторами (peroxisome proliferator-activated receptor - PPAR), γ-коактиватора-1, регулирующего коактиваторы γ-коактиватора-1α, -β, polycomb-репрессивного комплекса PRC и оказывающего влияние на различные сигнальные пути в зависимости от типа питания, воздействия различных факторов роста, температуры и других параметров. При этом в клетках Лейдига, вырабатывающих тестостерон, идентифицирована определяющая роль ключевого регулятора стероидогенеза γ-коактиватора-1, стимулирующего cAMP-PRKA, cGMP и β-адренергические рецепторы. Следует отметить, что стрессовая адаптация (стресс по Г.Селье) и стероидогенез в клетках Лейдига регулируются одними и теми же регуляторами, а синтез тестостерона коррелирует с уровнем стресса [9]. 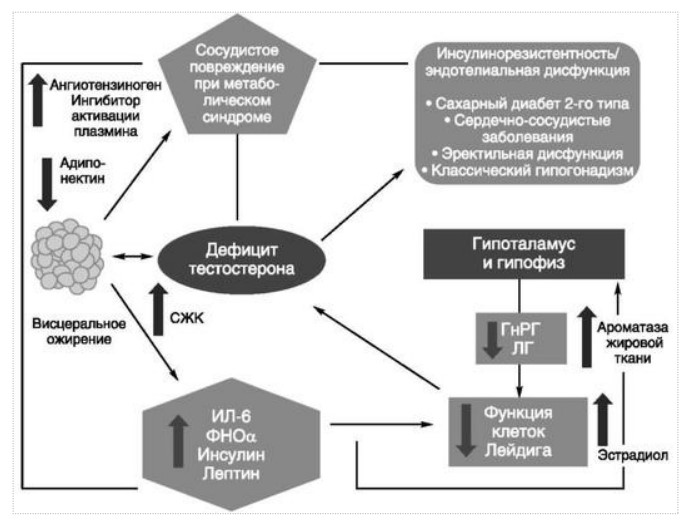 3Рис. 3.2. Патогенетическая взаимосвязь между мужским гипогонадизмом, висцеральным ожирением и сахарным диабетом 2-го типа. Адаптировано согласно С. Wang и соавт. [8] Показано, что даже у лиц без нарушения углеводного обмена имеется коррелятивная связь между снижением уровня общего тестостерона и развитием метаболического синдрома. При этом выявлена статистически достоверно значимая корреляция между уровнем общего тестостерона и обхватом талии (β = -0,395, p = 0,03), характеризующая степень выраженности абдоминального ожирения, а также между уровнем общего тестостерона и ЛПНП (β = 0,195, p = 0,04) [10]. Установлено, что у мужчин с висцеральным ожирением и артериальной гипертензией уровень общего тестостерона обратно пропорционален массе гипертрофированного левого желудочка, уровню пульсового давления и усилению отраженной пульсовой волны [11]. В настоящее время продолжаются дебаты о значимости коррекции уровня тестостерона при использовании тестостерон-заместительной терапии для снижения частоты развития сердечно-сосудистых событий [12, 13]. В ходе полемики в качестве аргументов приводятся результаты исследований, метаанализов и обобщенных обзоров, которые, как правило, характеризуются высокой гетерогенностью. При этом сторонники использования тестостерон-заместительной терапии задаются вопросом: «Не следует ли использовать тестостерон в качестве кардиологического препарата, в том числе для лечения хронической сердечной недостаточности?» [14, 15]. Согласно исследованию EMAS (European Male Aging Study Group), в котором приняли участие 2599 мужчин в возрасте 40-79 лет, проживающих в 8 европейских странах, мужской гипогонадизм ассоциируется с высокими показателями общей и сердечно-сосудистой смертности. Характерно, что данные показатели при этом в 2 раза превышают обще-популяционную смертность при уровне общего тестостерона менее 8 нмоль/л (отношение рисков = 2,3 [1,2; 4,2]) и возрастают еще более при сочетании с клиническими проявлениями мужского гипогонадизма (снижение либидо, эректильная дисфункция, снижение количества утренних эрекций) (отношение рисков = 3,2 [1,8-5,8]) [16]. Характерно, что в данном исследовании более низкий уровень тестостерона ассоциировался с развитием метаболического синдрома согласно критериям ATP-III (отношение шансов = 1,72, p <0,001). При этом выявленная ассоциация сохранялась и после проведения коррекции на уровень глобулина, связывающего половые гормоны, ИМТ и HOMA-IR (отношение шансов = 1,43, 1,44 и 1,64 соответственно, p <0,001) [17]. У пациентов с СД 2-го типа установлена тенденция к ассоциации между уровнем глобулина, связывающего половые гормоны, и уровнем половых гормонов. Так, риск развития СД 2-го типа снижается при повышении уровня глобулина, связывающего половые гормоны (отношение шансов = 0,30 [0,10-1,02]), и тестостерона (отношение шансов = 0,79 [0,41-1,72]). При этом увеличение уровня эстрадиола, напротив, повышает риск развития СД 2-го типа (отношение шансов = 1,33 [0,72-2,83]). Классическим исследованием метаболических свойств тестостерон-заместительной терапии у пациентов с висцеральным ожирением и мужским гипогонадизмом явилось двойное слепое плацебо-контролируемое рандомизированное клиническое исследование Moscow Study, результаты которого свидетельствуют о достоверно статистически значимом улучшении качества гликемического контроля, липидного обмена, снижении уровня провоспалительных цитокинов у пациентов, использовавших тестостерон-заместительную терапию [18]. АНТИОКСИДАНТНЫЕ СВОЙСТВА ТЕСТОСТЕРОНА Важным аспектом плейотропного эффекта тестостерона является его антиоксидантное действие, ставшее предметом пристального внимания исследователей в последнее десятилетие. При этом необходимо отметить превалирование исследований с использованием экспериментальных животных моделей, так как прямая оценка антиоксидантного эффекта тестостерона сопряжена с забором биопсийного материала таргетных органов. Между тем трендом рассмотрения данной проблемы у человека является, прежде всего, лабораторная оценка антиоксидантного статуса - как общего, так и изучение уровня отдельных ферментов, нейтрализующих свободные радикалы кислорода - активные формы кислорода (АФК). Следует отметить, что процесс образования и обезвреживания (нейтрализации) АФК является универсальным процессом и протекает во многих клетках, в том числе - в β-клетках поджелудочной железы и клетках Лейдига. Между тем в настоящее время оценивается также влияние таргетных гормонов с точки зрения их антиоксидантной активности. Следует более подробно охарактеризовать патофизиологию процесса окислительного стресса и в целом, и в мужской репродуктивной системе - в частности. Окислительный стресс усиливается в условиях высокой вариабельности гликемии. Свободные радикалы кислорода (АФК) вырабатываются в дыхательной цепи митохондрий, являющихся энергетической фабрикой клетки. АФК представляет собой группу короткоживущих низкомолекулярных соединений кислорода, основными из которых являются супероксид-анион O2-, перекись водорода H2O2, гидроксил-радикал OH- и пероксинитрит ONOO-. В физиологических количествах АФК осуществляют функцию сигнальных молекул трансдукции и являются необходимыми для обеспечения защиты клетки. Между тем в условиях окислительного стресса увеличивается количество высоко- реактивных АФК. При этом защитный процесс в митохондриях становится «самостоятельным», а патологический избыток свободных радикалов кислорода оказывает повреждающее действие на биологически важные макромолекулы - дезоксирибонуклеиновую кислоту, липиды, протеины, изменяя функционирование клетки. Необходимо отметить, что количество АФК как в норме, так и в условиях окислительного стресса регулируется при участии клеточных ферментов антиоксидантной защиты [супероксиддисмутазы (СОД), глутатионпероксидазы (ГПО), каталазы] или под действием экзогенно вводимых соединений с антиоксидантной активностью. В клетках имеется система антиоксидантной защиты, опосредованная антиоксидантными ферментами, локализованными в дыхательной цепи митохондрий (рис. 3.3 на цветной вклейке), клеточном цитозоле и внеклеточно. Нормальный процесс нейтрализации О2¯¯ протекает под действием трех основных ферментов - СОД, ГПО и каталазы, улавливающих АФК из «токсичных» реакций Фентона и Хабера-Вейсса (рис. 3.4 на цветной вклейке). Так, на первой линии защиты из супероксид-аниона в реакции дисмутации под действием СОД образуется менее реакцион-носпособная перекись водорода Н2О2. В дальнейшем перекись водорода в реакции, катализируемой каталазой, распадается на инертные молекулы кислорода и воды. Другой альтернативной физиологической реакцией распада перекиси водорода является образование воды под действием системы ГПО, сопряженной с системой никотинамидаде-ниндинуклеотидфосфат+/восстановленный никотинамидадениндину-клеотидфосфат2+ с участием фермента глутатионредуктазы. Таким образом, в нормально функционирующей клетке существует система антиоксидантной и прооксидантной защиты (табл. 3.1). В норме она работает как буфер. В условиях окислительного стресса преобладающими становятся повреждающие процессы дистресса и апоптоза. Ферментом, нейтрализующим свободнорадикальные частицы активного кислорода, является СОД, ключевой антиоксидантный фермент класса оксидоредуктаз. СОД защищает клетки от повреждающего воздействия активного кислорода и находится на первой линии взаимодействия с частицами активного кислорода. СОД снижает их токсичность посредством катализа (ускорения) дисмутазной реакции распада супероксидных радикалов на перекись водорода и молекулярный кислород. Впоследствии перекись водорода, образовавшаяся в реакциях окисления с участием СОД, разлагается под воздействием фермента каталазы. Селенсодержащий фермент ГПО при участии GSH катализирует восстановление гидроперекисей липидов до спиртов, а также перекиси водорода до воды (H2O2, ROOH). Восстановленный мономерный глутатион GSH переходит в дисульфид глутатиона GSSG с образованием соответствующего спирта и воды. При этом активность ГПО характеризует интенсивность функционирования глутатионового звена антиоксидантной системы и опосредует целостность мембран клеток и митохондрий [22]. Таблица 3.1. Основные составляющие антиоксидантной защиты у человека. Адаптировано согласно Kayama Y. и соавт. [20] 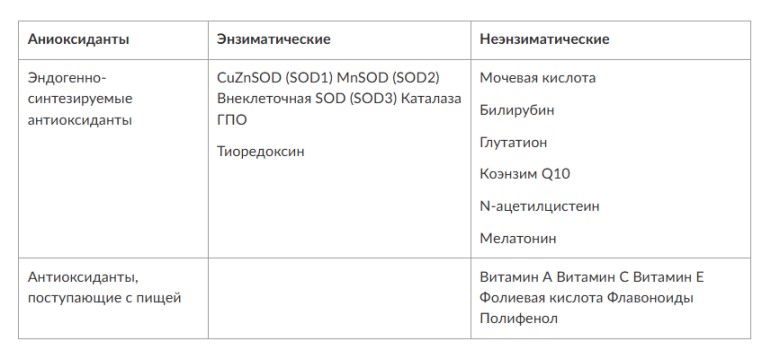 4Аниоксиданты Энзиматические Неэнзиматические Эндогенно-синтезируемые антиоксиданты CuZnSOD (SOD1) MnSOD (SOD2) Внеклеточная SOD (SOD3) Каталаза ГПО Тиоредоксин Мочевая кислота Билирубин Глутатион Коэнзим Q10 N-ацетилцистеин Мелатонин Антиоксиданты, поступающие с пищей Витамин А Витамин С Витамин Е Фолиевая кислота Флавоноиды Полифенол У пациентов с СД 2-го типа в условиях гипергликемического стресса усиливается митохондриальное образование АФК в митохондриях, изменяется профиль антиоксидантных ферментов (рис. 3.5), что предопределяет развитие каскада патологических процессов и прогрессирование диабетических осложнений. Кроме того, тестостерон влияет на интенсивность процесса гликолиза посредством воздействия на его ключевые ферменты - гексоки-назу-2, фосфофруктокиназу и глюкозо-6-фосфатазу, оказывая влияние на утилизацию глюкозы в пентозофосфатном шунте и цикле Кребса. Тестостерон также способствует повышению активности гликогенсинтетазы и снижению активности гликогенфосфорилазы, что усиливает гликогеногенез и снижает гликогенолиз. Установлено, что интенсивность процесса окислительного фосфорилирования в митохондриях зависит от уровня тестостерона. При воздействии тестостерона активируется убиквинол-цитохром С редуктаза и усиливается образование аденозинтрифосфата [4]. Актуальным является рассмотрение вопроса об отрезных точках (cut-off) уровня тестостерона для проведения тестостерон-заместительной терапии, регламентированных ныне действующими руководствами и гайдлайнами. Так, согласно Рекомендациям Международного общества по изучению вопросов старения мужчин ISSAM [24] и Европейской урологической ассоциации EAU [25], нижней границей нормы следует считать уровень общего тестостерона 12,1 нмоль/л и свободного тестостерона 243 пмоль/л. Эндокринологическое общество США в качестве отрезных точек мужского гипогонадизма рассматривает значения 10,4 нмоль/л и 310 пмоль/л для общего и свободного тестостерона соответственно [26]. При этом, согласно Рекомендациям Международного общества сексуальной медицины ISSM, тестостерон-заместительная терапия показана всем пациентам с уровнем общего тестостерона менее 8 нмоль/л (тяжелая степень андрогенодефицита), а также пациентам с уровнем тестостерона 8-12,1 нмоль/л (легкая степень андрогенодефицита) при наличии симптомов дефицита андрогенов [27]. В Проекте Российских рекомендаций по диагностике и лечению гипогонадизма у мужчин в качестве порогового значения предложен уровень общего тестостерона 12,1 нмоль/л [28]. 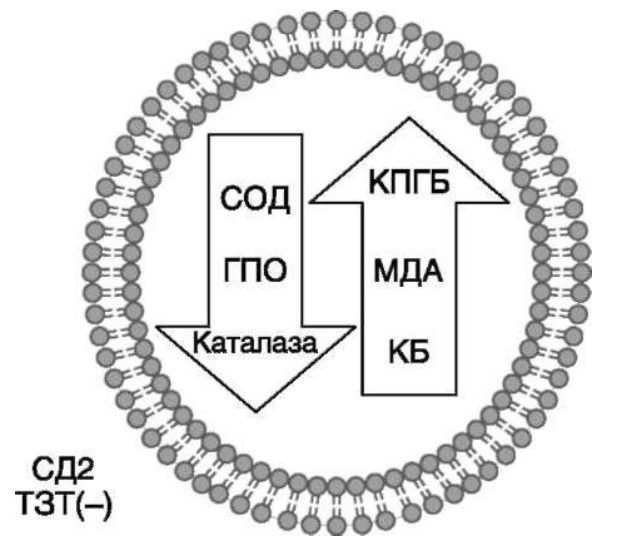 5Рис. 3.5. Профиль антиоксидантных ферментов в условиях глюкозо- и липотоксичности: ТЗТ - тестостерон-заместительная терапия; МДА - малоновый диальдегид; КПГБ - конечные продукты гликирования белков; КБ - карбонилированные белки. Адаптировано согласно Tiwari B.K. и соавт. [23] ТЕСТОСТЕРОН-ЗАМЕСТИТЕЛЬНАЯ ТЕРАПИЯ И КАЧЕСТВО ЖИЗНИ В настоящее время актуальное значение приобретает не только достижение целевых гликемических и негликемических метаболических показателей у пациентов с СД 2-го типа, но и сохранение высо- кого качества жизни. У страдающих СД мужчин высокое качество жизни неотъемлемо ассоциируется с высоким качеством мужского здоровья. Качество мужского здоровья может быть оценено не только субъективно, но и на основе количественных критериев - данных лабораторно-инструментального обследования и балльной оценки по опроснику шкалы симптомов старения мужчины (Aging Males? Symptoms - AMS) и шкале Международного индекса эректильной дисфункции (МИЭФ-5). СД 2-го типа оказывает многогранное влияние на ухудшение качества мужского здоровья. Установлен сосудистый (венозный, артериальный, смешанный), нейрогенный генез эректильной дисфункции (усугубляемый воздействием гипергликемии и дислипидемии), а также роль психогенного компонента. Необходимо отметить, что в сравнении с общей популяцией у пациентов с СД 2-го типа не только чаще отмечается метаболически обусловленный компонент эректильной дисфункции, но имеет место и прогрессирующее превалирование психогенного компонента. Так, у пожилых пациентов на течении СД 2-го типа негативно отражается не только длительность заболевания с момента установления диагноза, но также и присоединение метаболического возрастного андрогенодефицита. Между тем у пациентов с СД 2-го типа дислипидемия и артериальная гипертензия, сопутствующие глюкозотоксичности, оказывают отрицательное влияние на прогрессирование эндотелиальной дисфункции и выраженность клинических проявлений эректильной дисфункции. Следует также отметить отрицательный вклад ассоциированной с возрастом и СД 2-го типа тревожности, депрессии, когнитивных расстройств. Кроме того, у таких пациентов отмечается сужение диапазона интересов - активный отдых становится более редким и менее продолжительным, присоединяется негативное влияние чувства утраты близких людей, что может явиться причиной длительной депривации и усиления воздействия психогенного компонента. О многофакторном генезе нарушений мужской половой функции при СД 2-го типа и висцеральном ожирении свидетельствует также присоединение урологических, ассоциированных с возрастом состояний, таких как доброкачественная гиперплазия предстательной железы и синдром нижних половых путей. Между тем в последней (седьмой) редакции «Алгоритмов специализированной медицинской помощи больным СД» отсутствуют рекомендации по коррекции эректильной дисфункции и возрастного андрогенного дефицита у пожилых пациентов с СД 2-го типа и не сделан акцент на возможностях заместительной гормональной терапии препаратами тестостерона у пожилых пациентов [29]. ДАННЫЕ СОБСТВЕННЫХ РАНДОМИЗИРОВАННЫХ И НАБЛЮДАТЕЛЬНЫХ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ, ОЦЕНИВАЮЩИХ ЭФФЕКТИВНОСТЬ И БЕЗОПАСНОСТЬ ТЕСТОСТЕРОН-ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ На кафедре диабетологии РМАПО под руководством профессора А.С. Аметова была выполнена серия оригинальных клинических исследований. Основной целью данных исследований явилась оценка метаболического, антиоксидантного и антидепрессантного эффекта тестостерон-заместительной терапии (ТЗТ) и выявление связи антиоксидантного статуса и метаболических параметров при использовании данной терапии у пациентов с СД 2-го типа, висцеральным ожирением и мужским гипогонадизмом. В клиническом наблюдательном исследовании приняли участие 124 пациента, страдающих СД 2-го типа с диагностированным мужским гипогонадизмом. Средний возраст пациентов составил 55,8±8,9 года, длительность заболевания с момента установления диагноза СД 2-го типа - 5,8±4,1 года, медиана ИМТ - 31,9±3,9 кг/м2. Предшествующие включению в исследование схемы сахароснижаю-щей, гиполипидемической и антиагрегантной терапии в ходе проведения исследования оставались неизменными. В исследуемой выборке не все пациенты имели целевые значения параметров гликемического контроля и липидного профиля (однако отклонения не были значительными). Пациенты методом генерирования случайных чисел были рандомизированы (1 : 1) на две группы в зависимости от использования терапии препаратами тестостерона. Пациенты основной группы получали в течение 12 мес препараты тестостерона накожно - гель тестостерона «Андрогель» 1 пакет в сутки (5 г геля = 50 мг тестостерона). Пациенты контрольной подгруппы тестостерон-заместительную терапию не использовали. Антропометрические параметры и метаболические параметры пациентов основной и контрольной групп оказались сопоставимыми. Дизайн исследования представлен на рис. 3.6 на цветной вклейке. Результаты данного исследования подтвердили тесную взаимосвязь между метаболическим, тестостероновым и антиоксидантным статусом при сочетании СД 2-го типа и мужского гипогонадизма. Установлено, что висцеральное ожирение, ассоциированное с развитием СД 2-го типа, отягощает достижение терапевтического эффекта вследствие развития глюкозолипотоксичности. Характерно, что глюкозолипотоксичность у пациентов с СД 2-го типа, висцеральным ожирением и гипогонадизмом сопровождается усилением интенсив- ности окислительного стресса и формированием плохой метаболической памяти вследствие эпигенетических изменений, опосредованных данными процессами [3]. Безусловно, тестостерон не следует рассматривать как препарат с целенаправленным сахароснижающим или гиполипидемическим эффектом. Между тем тестостерон-заместительная терапия ассоциируется с выраженным снижением глю-козолипотоксичности и окислительного стресса. Так, использование тестостерон-заместительной терапии ассоциируется со снижением уровня HbA1c. Отмечено статистически достоверно значимое улучшение «классических» параметров углеводного обмена - гликемии натощак, ППГ и HbA1c. При этом установлено более выраженное снижение ППГ в сравнении с гликемией натощак. Улучшение качества гликемического контроля отмечалось через 6 мес от начала использования тестостерон-заместительной терапии и сохранялось на протяжении всего периода наблюдения (рис. 3.7). Динамика гликемических показателей рассматривалась как статистически достоверно значимая не только в сравнении с исходными показателями, но и с результатами динамики углеводного обмена в контрольных точках 6 и 12 мес. 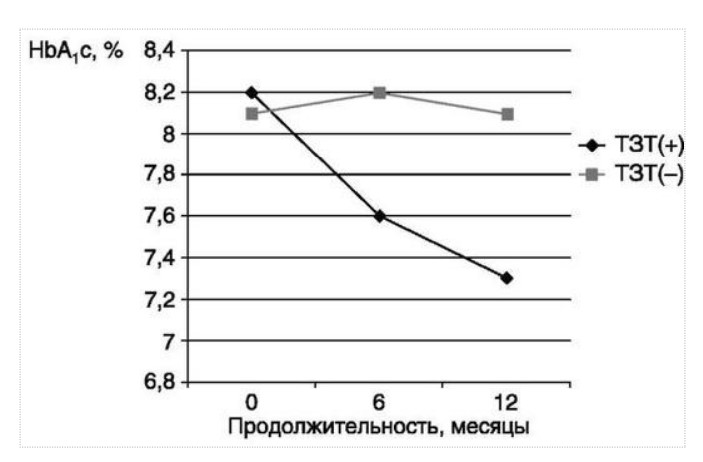 6Рис. 3.7. Динамика уровня гликированного гемоглобина у пациентов с сахарным диабетом 2-го типа на фоне тестостерон-заместительной терапии и в ее отсутствие У пациентов с СД 2-го типа, развившимся на фоне висцерального ожирения, диагностировано нарушение липидного обмена, рассматриваемого в рамках описания классической диабетической дислипидемической триады (повышение уровня триглицеридов и общего холестерина в сочетании со снижением уровня ЛПВП). Показано, что набор массы тела лишь усугубляет степень выраженности дислипидемии. Между тем отмеченное в основной группе пациентов снижение массы тела ассоциировалось с улучшением динамики липидного обмена (рис. 3.8). 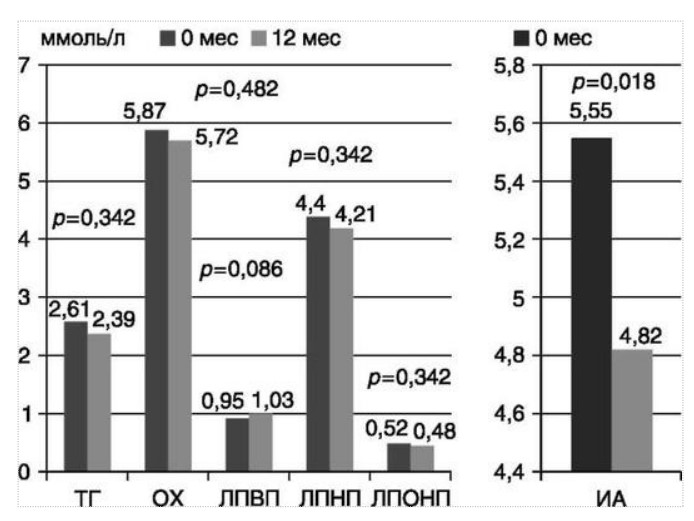 7Рис. 3.8. Динамика показателей липидограммы у пациентов с сахарным диабетом 2-го типа на фоне тестостерон-заместительной терапии Таким образом, при использовании тестостерон-заместительной терапии отмечается ее положительное воздействие на метаболические характеристики углеводного и липидного обмена, о чем свидетельствовало снижение глюкозолипотоксичности у пациентов основной группы. Между тем в представленном исследовании продемонстрировано, что положительный метаболический эффект тестостерон-заместительной терапии неразрывно ассоциируется с антиоксидантными свойствами тестостерона. Так, на фоне использования препаратов тестостерона у пациентов с СД 2-го типа и висцеральным ожирением основной группы обнаружено статистически достоверно значимое повышение уровня основных маркеров окислительного стресса в сравнении с контрольной группой (рис. 3.9). В данном исследовании предложен показатель динамики интенсивности окислительного стресса ΔOxS, рассматриваемого в качестве оценочного показателя динамики (снижения) повреждающего действия 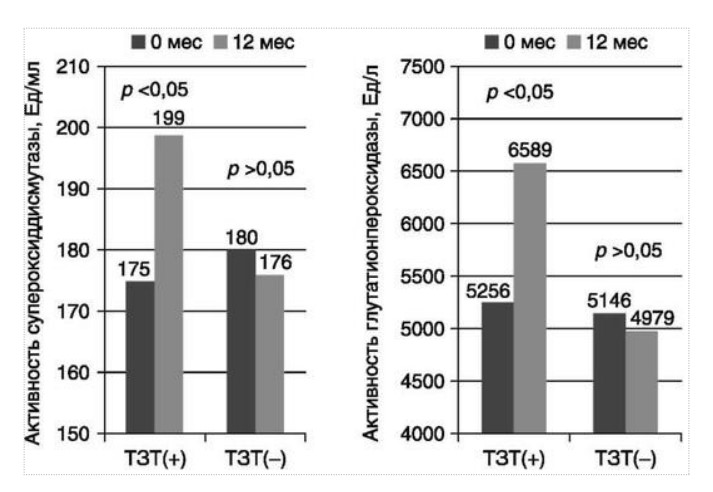 8Рис. 3.9. Динамика показателей окислительного стресса у пациентов с сахарным диабетом 2-го типа на фоне тестостерон-заместительной терапии в течение 12 мес свободнорадикального окисления, ассоциированного с развитием глюкозолипотоксичности. Для расчета показателя ΔOxS могут быть использованы данные о достижении целевых значений основных гликемических и внегликемических показателей, оцениваемых в рутинной эндокринологической практике. Показатель ΔOxS является полуколичественным и отражает динамику выраженности окислительного стресса в условиях глюкозолипотоксичности. Показатель ΔOxS является интегральным, так как отражает динамику интенсивности окислительного стресса, обусловленную изменением нескольких составляющих ΔOxS = (отношение снижения индекса атерогенности) × (отношение снижения HbA1c) / [(отношение снижения СОД) × (отношение снижения ГПО)], доли (рис. 3.10). При улучшении метаболических показателей глюкозолипотоксичности и антиоксидантного статуса показатель не превышает единицу. При этом значение ΔOxS, превышающее единицу, свидетельствует об усилении окислительного стресса у рассматриваемого пациента. Показатель ΔOxS предусматривает динамическую оценку четырех основных нарушений метаболических параметров, ассоциированных с окислительным стрессом - гипергликемии, дислипидемии, снижения антиоксидантной активности ферментов СОД и ГПО. 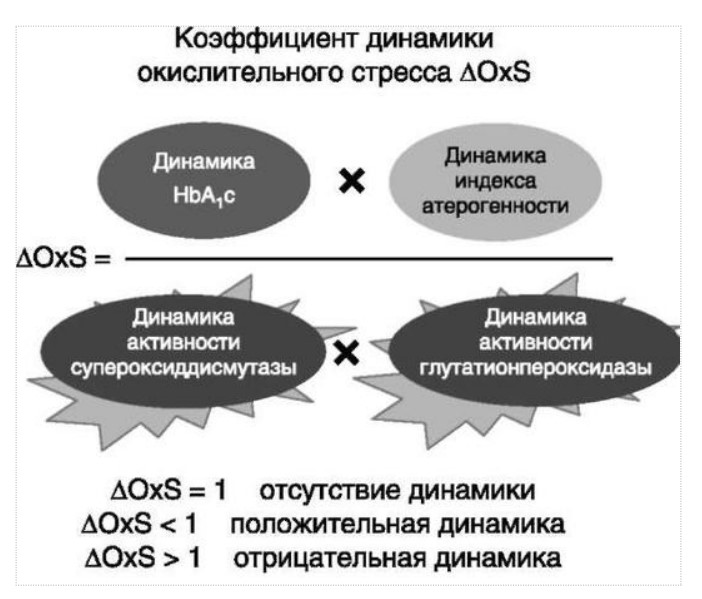 9Рис. 3.10. Показатель динамики окислительного стресса - индекс ΔOxS На фоне проведения тестостерон-заместительной терапии показатель ΔOxS снижается, что свидетельствует о положительных метаболических и антиоксидантных свойствах тестостерона. Таким образом, на фоне тестостерон-заместительной терапии эффект тестостерона у пациентов с СД 2-го типа заключается в устранении 1) гипергликемии, запускающей каскад избыточного образования свободных радикалов кислорода; 2) гиперлипидемии, определяющей количество метаболического субстрата, вступающего в реакцию перекисного окисления липидов, а также 3) снижении антиоксидантной активности СОД (первичного сквеллера свободных радикалов) и 4) снижении активности ГПО, антиоксидантного фермента глутатионового цикла (сквеллера свободных радикалов на второй линии антиоксидантной защиты). При назначении тестостерон-заместительной терапии было отмечено повышение индекса ΔOxS, что свидетельствует об уменьшении выраженности окислительного стресса (рис. 3.11). Назначение тестостерон-заместительной терапии пациентам с СД 2-го типа и мужским гипогонадизмом уменьшает последствия окислительного стресса, что сопровождается снижением образования АФК в митохондриях и нормализацией профиля антиоксидантных ферментов (рис. 3.12). Таким образом, коррекция уровня тестостерона и его плейотропное антиоксидантное действие минимизирует риск развития диабетических осложнений (рис. 3.13). 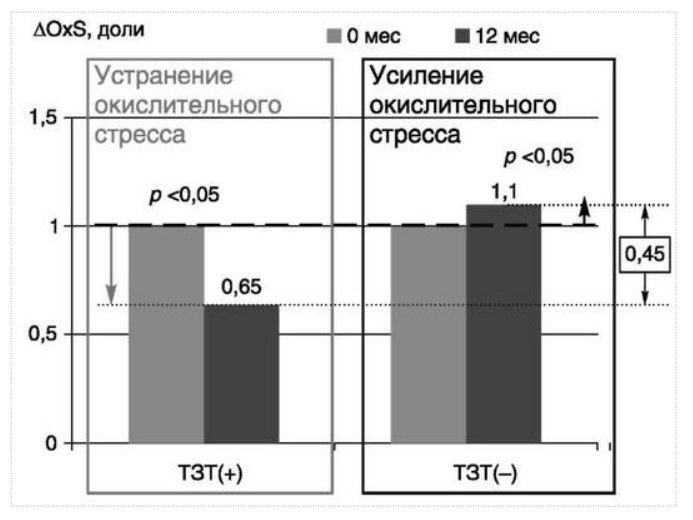 10Рис. 3.11. Динамика показателей липидограммы у пациентов с сахарным диабетом 2-го типа на фоне тестостерон-заместительной терапии и в ее отсутствие 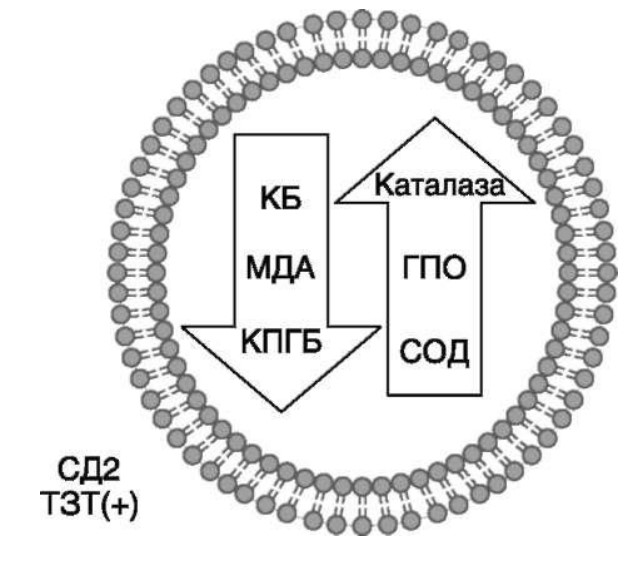 11Рис. 3.12. Профиль антиоксидантных ферментов у пациентов с сахарным диабетом 2-го типа в условиях глюкозо- и липотоксичности. Адаптировано согласно Tiwari B.K. и соавт. [23]  12Рис. 3.13. Последствия окислительного стресса при сахарном диабете. Адаптировано согласно Araki E. и Nishikawa T. [21] ТЕСТОСТЕРОН-ЗАМЕСТИТЕЛЬНАЯ ТЕРАПИЯ У ПОЖИЛЫХ Нами проведено дополнительное профильное исследование с целью оценки качества мужского здоровья у пожилых пациентов с СД 2-го типа и рассмотрения возможности его улучшения и влияния тестостерон-заместительной терапии на нормализацию метаболических показателей. В данное исследование включено 87 мужчин с СД 2-го типа (длительность установления диагноза 0-17, медиана - 5,5 года). Обследовано 53 пациента с СД 2-го типа в возрасте 60+ (средний возраст - 65,7±4,3 года). Основную группу составили 27 пациентов с СД 2-го типа старше 60 лет, получавшие тестостерон-заместительную терапию. В контрольную группу включено 26 их ровесников с СД 2-го типа, не получавших тестостерон-заместительную терапию. Группу сравнения составили 34 лица с СД 2-го типа и висцеральным ожирением более молодого возраста (средний возраст 51,5±7,3 года), также получавшие тестостерон-заместительную терапию. Использованы два варианта тестостерон-заместительной терапии. Применялась накожная гелевая форма тестостерона Андрогель 50 мг 1 раз/сут или использовались внутримышечные инъекции тестостерона ундеканоата (Небидо 1 г/амп., вторая инъекция - через 6 нед, в последующем - через 10-14 нед в зависимости от уровня тестостерона). В ходе исследования оценивалась динамика различных метаболических и психических показателей среди пожилых лиц с СД 2-го типа, висцеральным ожирением (ИМТ - 31,8±4,4 кг/м2, окружность талии - 105,0±10,0 см, окружность талии/окружность бедер = = 1,05±0,48) и мужским гипогонадизмом, получавших и не получавших тестостерон-заместительную терапию. Показано, что развитие и прогрессирование СД 2-го типа у мужчин ассоциируется с развитием мужского гипогонадизма как в пожилом, так и в более молодом возрасте. При этом установлено, что в старшей возрастной группе дополнительный вклад в развитие андрогенного дефицита вносит возрастной андрогенодефицит. Так, уровень глобулина, связывающего половые гормоны, оказался достоверно значимо выше в группе пожилых пациентов в сравнении с более молодыми (38,4±6,2 и 20,1±4,6 нмоль/л соответственно, p <0,05). Коррекция мужского гипогонадизма с использованием тестостерон-заместительной терапии (инъекционные и пластырные формы) способствовала повышению уровня общего тестостерона как в основной группе, так и в группе сравнения (до 17,4±4,2 и 24,1±4,9 нмоль/л соответственно, p <0,05). При этом в контрольной группе ровесников, у которых имелись метаболические или социальные противопоказания к использованию препаратов тестостерона, уровень общего тестостерона составил 12,2±2,0 нмоль/л в сравнении с основной интервенционной группой (p <0,05). Показано, что проведение в течение 6 месяцев тестостерон-заместительной терапии у пожилых пациентов способствовало улучшению метаболических параметров в сравнении с пожилыми пациентами, не получавшими препараты тестостерона. Так, межгрупповое различие основных метаболических параметров у пожилых пациентов основной и контрольной групп составило: для гликемии натощак -0,56 ммоль/л (р <0,05), HbA1c - -0,62% (p <0,05), общего холестерина - -0,59 ммоль/л (p <0,05), ЛПВП (повышение) - +0,36 ммоль/л (p <0,05), ЛПНП - -1,08 ммоль/л (p <0,05), триглицеридов - -0,42 ммоль/л (p <0,05), индекса атерогенности - -2,1 (p <0,05) в пользу получавших препараты тестостерона. Также на фоне тестостерон-заместительной терапии отмечено улучшение андрогенного статуса у пожилых пациентов с СД 2-го типа. Обращает внимание достоверно значимое снижение массы тела (на 1,8 кг, p <0,05), окружности талии (на 2,1 см, p <0,05), окружности талии/окружности бедер (на 0,05, p <0,05) и уровня висцерального жира (на 0,6 ЕД, p <0,05). С целью оценки влияния тестостерон-заместительной терапии на качество жизни пожилых пациентов с СД 2-го типа изучена динамика балльной оценки - на основе использования балльных опросников МИЭФ-5, AMS и шкалы депрессии Бека. Установлена положительная динамика балльной оценки МИЭФ-5 во всех возрастных группах. Πри выходе из исследования средняя балльная оценка МИЭФ-5 превышала 20 баллов. Между тем исходная балльная оценка МИЭФ-5 в среднем оказалась ниже у пациентов группы 60+ (15,4±2,4 в сравнении с 16,4±2,1, p <0,05) (рис. 3.14,а на цветной вклейке). Использование тестостерон-заместительной терапии у пожилых пациентов с СД 2-го типа позволило скорректировать ассоциированный с возрастом компонент эректильной дисфункции. Коррекция возрастного андрогенного дефицита способствовала улучшению метаболических и психологических характеристик, оценивающих вклад возрастного андрогенного дефицита. Так, через 6 месяцев с момента старта тестостерон-заместительной терапии установлена средней силы отрицательная коррелятивная связь между возрастом пациентов и балльной оценкой по шкале AMS (r=-0,304) (рис. 3.14,б на цветной вклейке). Оценена динамика выраженности депрессии на фоне проведения тестостерон-заместительной терапии. Выявлено, что применение препаратов тестостерона способствовало снижению балльной оценки по шкале Бека, однако было сильнее выражено у более молодых пациентов. B представленном нами исследовании изучена эффективность и безопасность использования тестостерон-заместительной терапии у пожилых пациентов с СД 2-го типа. Подтверждено не только улучшение тестостеронового статуса per se, но и положительная динамика показателей метаболического и психического статуса (выраженности депрессии) как у молодых, так и пожилых пациентов, получавших препараты тестостерона (рис. 3.15). Выявлено и положительное межгрупповое различие в пользу пациентов основной интервенционной группы пожилых пациентов, получавших тестостерон-заместительную терапию, в сравнении с контрольной группой. На фоне проведения тестостерон-заместительной терапии препаратами тестостерона отмечено повышение качества, количества и твердости эрекций в обеих возрастных группах пациентов с СД 2-го типа. При этом характерно то, что перед включением в исследование у пожилых пациентов отмечалось более выраженное нарушение эректильной дисфункции (межгрупповое различие основной и контрольной групп - 2 балла по шкале МИЭФ-5 в пользу более молодых пациентов). Улучшение показателей метаболического здоровья и качества мужского здоровья нашло отражение в положительной динамике баллов по шкале AMS. У пациентов с СД 2-го типа не только в пожилом, но и молодом возрасте выявлено снижение уровня возрастного андро- 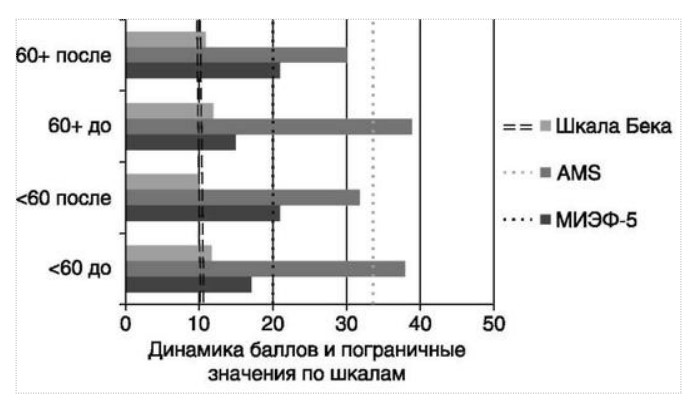 13Рис. 3.15. Суммарная оценка динамики балльной оценки по шкалам симптомов старения мужчины, Международного индекса эректильной дисфункции-5 и депрессии Бека на фоне проведения тестостерон-заместительной терапии и оценочные границы интерпретации генного дефицита, превышающего оптимальные значения при наличии мужского гипогонадизма, отмеченного до старта тестостерон-заместительной терапии препаратами тестостерона. Важно отметить, что улучшение качества мужского здоровья в сочетании с улучшением метаболических показателей и снижением массы тела способствовало снижению уровня депрессии, однако у пожилых пациентов степень снижения выраженности симптомов депрессии, оцениваемой по шкале депрессии Бека, оказалось менее значительным. Следует отметить, что и исходные показатели в обеих группах до начала тестостерон-заместительной терапии соответствовали среднему интервалу субдепрессии. При этом назначение препаратов тестостерона способствовало смещению уровня депрессии к границе субдепрессии и нормальных показателей через 6 мес после стартового назначения тестостерон-заместительной терапии. Между тем проведение у пожилых пациентов тестостерон-заместительной терапии в меньшей степени вызывало снижение уровня депрессии. С целью уточнения данной тенденции осуществлена стратификация общей балльной оценки по когнитивно-аффективной субшкале и субшкале соматических проявлений депрессии (пункты 1-13 и 14-21 опросника Бека соответственно). Установлено, что при сопоставимом улучшении соматических аспектов депрессии в основной группе и группе сравнения проведение тестостерон-заместительной терапии обнаружило меньшую положительную динамику по когнитивно-аффективной шкале, что объяснимо с точки зрения меньшего вклада качества мужского здоровья в структуру психического здоровья у пожилых пациентов. Таким образом, можно полагать, что у пожилых пациентов с СД 2-го типа коррекция мужского гипогонадизма, несомненно, способствует улучшению психического здоровья, ассоциированного с метаболическим статусом. При этом эмоциональное и когнитивное восприятие факта улучшения качества мужского здоровья у пожилых оказывается менее значимым в сравнении с более молодыми пациентами. Следовательно, определяющий вклад в развитие депрессии вносят, прежде всего, социальные факторы, которые не связаны с проблемой коррекции эректильной дисфункции. Менее выраженную степень снижения проявлений депрессии по шкале Бека при проведении тестостерон-заместительной терапии у пожилых пациентов следует рассматривать с точки зрения многокомпонентного генеза депрессии в данной возрастной группе и меньшего вклада проблем, связанных с эректильной дисфункцией, в структуру психосоматического статуса (см. рис. 3.15). Обращает внимание большая длительность СД 2-го типа с момента установления диагноза в группе пожилых пациентов и, исходя из этого, более продолжительное отрицательное воздействие гипергликемии на сосудистую стенку. Кроме того, более высокая коморбидность, ассоциируемая с пожилым возрастом, также способствует более значительному вкладу сосудистого и нейрогенного компонента в генез эректильной дисфункции, что у некоторых пациентов не позволяет устранить ее клинические проявления даже при нормализации уровня свободного тестостерона. Однако в целом проведение тестостерон-заместительной терапии у пожилых пациентов способствует как улучшению соматического, так и психического здоровья. Между тем установлено, что нормализация уровня свободного тестостерона, независимо от его влияния на качество мужского здоровья, достоверно значимо способствует улучшению метаболических показателей углеводного и липидного обмена. Оценивая в представленном исследовании динамику метаболического статуса при проведении тестостерон-заместительной терапии, необходимо отметить, что снижение уровня общего и свободного тестостерона у пожилых пациентов с СД 2-го типа в русской популяции ассоциируется с большей выраженностью клинических проявлений эректильной дисфункции и депрессии. Аналогичная зависимость выявлена и у пожилых пациентов (65+), проживающих в США [30] и развивающихся странах [31]. B ряде зарубежных исследований продемонстрирована сильная отрицательная коррелятивная связь между уровнем тестостерона и выраженностью депрессии [32]. B представленном исследовании данная связь была расценена как положительная слабой силы, что, безусловно, может быть объяснимо большим влиянием социально-экономических проблем на степень выраженности депрессии у пожилых мужчин российской популяции. Установлено положительное влияние успешной коррекции эректильных нарушений на психическое состояние пациента. Результаты проведенного исследования подтверждают положение о том, что у пожилых пациентов возраст и депрессия вносят независимый друг от друга негативный вклад в развитие эректильной дисфункции. Это согласуется с данными, представленными в работе Ma B.O. и соавт. [33], обследовавших когорту пациентов с хроническими вирусными гепатитами, сочетавшимися с СД. Показано также, что своевременное выявление и коррекция эректильной дисфункции позволяет предотвратить физический и эмоциональный дискомфорт пациента с соматическими заболеваниями [34, 35]. Объем предстательной железы (Vпр.ж.) оценивался в рамках изучения безопасности тестостерон-заместительной терапии. Подтвержден ассоциированный с возрастом характер усиления выраженности проявлений эректильной дисфункции, снижения уровня тестостерона, увеличения Vпр.ж., а также выраженности клинических симптомов, свидетельствующих о развитии депрессивных состояний. Более высокий объем предстательной железы отмечен у пациентов с более низким уровнем тестостерона (r=-0,143) и большей выраженностью депрессии, оцененной по шкале Бека (r=-0,165). На фоне тестостерон-заместительной терапии у изученных пациентов достоверно значимого увеличения Vпр.ж. не было обнаружено. Наши данные также согласуются с результатами исследования Pietrzyk В. и соавт. [32], в котором была установлена ассоциация между наличием у пациента доброкачественной гиперплазии предстательной железы и выраженностью депрессии. В проведенном исследовании показано, что улучшение тестостеронового статуса у пожилых пациентов с СД 2-го типа и устранение проявлений эректильной дисфункции ассоциируется с улучшением метаболических параметров углеводного и липидного обмена, а также со снижением степени выраженности депрессии, что согласуется с концепцией СД 2-го типа как психосоматического заболевания. ТЕСТОСТЕРОН-ЗАМЕСТИТЕЛЬНАЯ ТЕРАПИЯ И БАРИАТРИЧЕСКАЯ ХИРУРГИЯ Реалиями нашего времени является все более широкое использование метаболической хирургии, применение которой может сопровождаться ремиссией СД 2-го типа. При этом ответ на инкретиновую и/или тестостерон-заместительную терапию у пациентов с СД 2-го типа следует рассматривать в качестве критерия терапевтического отбора для бариатрических вмешательств. Между тем следует учитывать, что хирургическое вмешательство у пациентов с СД 2-го типа и ожирением сопряжено с операционным и анестезиологическим риском и предусматривает наблюдение эндокринологом не только в послеоперационном периоде, но и пожизненно. Следует учитывать, что у некомплаентных пациентов, перенесших бариатрическое вмешательство, может отмечаться набор массы тела, сопровождаемый рецидивом СД 2-го типа. Наиболее сложно найти ответ на этот вопрос среди пациентов, страдающих мужским гипогонадизмом. Необходимо отметить, что на эндокринологический прием все чаще обращаются пациенты с просьбой сравнительной оценки потенциального успеха традиционной терапевтической практики снижения массы тела и бариатрического вмешательства. Представленное нами оригинальное исследование выполнено в профильной когорте коморбидных пациентов с СД 2-го типа, висцеральным ожирением и мужским гипогонадизмом. B ходе исследования ретроспективно изучены 94 случая обращения на амбулаторный эндокринологический прием пациентов профильной когорты, страдающих СД 2-го типа в сочетании с висцеральным ожирением и мужским гипогонадизмом. B каждом случае обсуждался вопрос о возможности планового проведения бариатрических операций. Средний возраст пациентов составил 52±9,4 года, длительность СД с момента установления диагноза - 5,6±3,4 года, средний уровень HbA1c - 7,9±1,4%, ИМТ - 37,8±4,3 кг/м2. Bсе пациенты страдали мужским гипогонадизмом, подтвержденным лабораторно двукратным снижением уровня тестостерона <12 нмоль/л. Для улучшения качества гликемического контроля были использованы инкретиномиметик лираглитуд 1,8 мг/сут, для коррекции мужского гипогонадизма применялись пластырные формы препаратов тестостерона (Андрогель 50 мг накожно ежедневно). У 72 из 94 пациентов использовано сочетание двух терапевтических опций. Динамика метаболического и тестостеронового статуса оценивалась в течение 6 мес проведения тестостерон-заместительной и инкретиновой терапии. Было показано, что неэффективный ответ, связанный с использованием инкретиновой и/или тестостерон-заместительной терапии, через 6 мес обнаружен лишь у 18 из 94 пациентов с СД 2-го типа, висцеральным ожирением в сочетании с мужским гипогонадизмом и оказался наименьшим в группе двойной терапии (рис. 3.16). При этом Таблица 3.2. Динамика метаболических и антропометрических параметров у пациентов с сахарным диабетом 2-го типа, ожирением в сочетании с мужским гипoгoнaдизмoм с эффективным и неэффективным ответом на инкpeтинoвyю и/или тестостерон-заместительную терапию 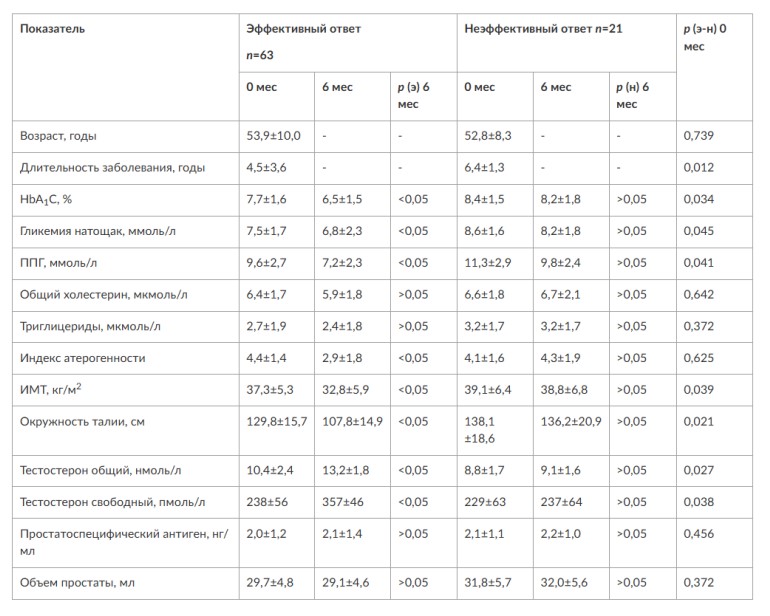 14Показатель Эффективный ответ n=63 Неэффективный ответ n=21 p (э-н) 0 мec 0 мec 6 мec p (э) 6 мec 0 мec 6 мec p (н) 6 мec Возраст, годы 53,9±10,0 - - 52,8±8,3 - - 0,739 Длительность заболевания, годы 4,5±3,6 - - 6,4±1,3 - - 0,012 HbA1C, % 7,7±1,6 6,5±1,5 <0,05 8,4±1,5 8,2±1,8 >0,05 0,034 Гликемия натощак, ммоль/л 7,5±1,7 6,8±2,3 <0,05 8,6±1,6 8,2±1,8 >0,05 0,045 ΠΠΓ, ммоль/л 9,6±2,7 7,2±2,3 <0,05 11,3±2,9 9,8±2,4 >0,05 0,041 Общий холестерин, мкмoль/л 6,4±1,7 5,9±1,8 >0,05 6,6±1,8 6,7±2,1 >0,05 0,642 Tpиглицepиды, мкмoль/л 2,7±1,9 2,4±1,8 >0,05 3,2±1,7 3,2±1,7 >0,05 0,372 Индекс атерогенности 4,4±1,4 2,9±1,8 <0,05 4,1±1,6 4,3±1,9 >0,05 0,625 ИMT, кг/м2 37,3±5,3 32,8±5,9 <0,05 39,1±6,4 38,8±6,8 >0,05 0,039 Окружность талии, см 129,8±15,7 107,8±14,9 <0,05 138,1 ±18,6 136,2±20,9 >0,05 0,021 Тестостерон общий, нмоль/л 10,4±2,4 13,2±1,8 <0,05 8,8±1,7 9,1±1,6 >0,05 0,027 Тестостерон свободный, пмoль/л 238±56 357±46 <0,05 229±63 237±64 >0,05 0,038 Πpocтaтocпeцифичecкий антиген, нг/мл 2,0±1,2 2,1±1,4 >0,05 2,1±1,1 2,2±1,0 >0,05 0,456 Объем простаты, мл 29,7±4,8 29,1±4,6 >0,05 31,8±5,7 32,0±5,6 >0,05 0,372 ρ (э) 6 мec - в группе эффективного ответа 6 мec vs 0 мec. ρ (н) 6 мec - в группе неэффективного ответа 6 мec vs 0 мec. ρ (э-н) 0 мec - в группах эффективного vs неэффективного ответа. предикторами неэффективного ответа явились более высокий ИМТ, плохое исходное качество гликемического контроля и отсутствие коррекции мужского гипогонадизма (табл. 3.2). 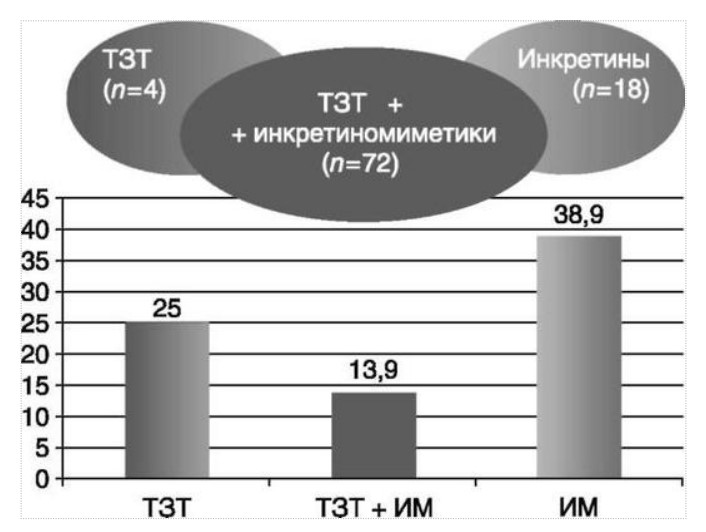 15Рис. 3.16. Неэффективность ответа у пациентов с сахарным диабетом 2-го типа и мужским гипогонадизмом в течение 6 мес на фоне инкретиновой (ИМ) и/или тестостеронзаместительной терапии (ТЗТ) Таким образом, результаты представленного исследования свидетельствуют о том, что улучшение качества гликемического контроля, основанное на включении инкретиномиметиков в схему сахароснижа-ющей терапии и модулировании инкретинового эффекта, сопровождается снижением массы тела. Кроме того, коррекция мужского гипогонадизма также способствует снижению массы тела. Эффект усиливается при сочетании двух терапевтических опций. Результаты исследования свидетельствуют о том, что отсутствие ответа на инкретиновую и/или тестостерон-заместительную терапию следует использовать в качестве абсолютного критерия отбора пациентов с СД 2-го типа и висцеральным ожирением для выполнения бариатрических вмешательств. В то же время неэффективный ответ был отмечен только у 10,1% пациентов. При этом в других 89,9% случаях эффективного ответа следует персонализированно рассмотреть вопрос о выборе наиболее приемлемой метаболической стратегии и тактики - терапевтической или бариатрической. Общим в развитии прямого сахароснижающего действия при использовании терапевтических (инкретиномиметик лираглутид) и бариатрических опций является восстановление нарушенного при СД 2-го типа инкретинового ответа. Вторым ключевым патогенетическим звеном, ассоциированным со снижением массы тела у пациентов с СД 2-го типа, является коррекция мужского гипогонадизма смешанного генеза, развивающегося на фоне висцерального ожирения и возрастного андрогенного дефицита. Установлено, что пациенты с СД 2-го типа имеют более низкий уровень тестостерона. Кроме того, в проспективных исследованиях показано, что у лиц с низким уровнем тестостерона риск развития СД 2-го типа возрастает. При этом фармакологическая коррекция уровня тестостерона способствует улучшению метаболических показателей. Установлено, что фармакологическая коррекция уровня тестостерона способствует улучшению метаболических показателей. Долгосрочное проведение тестостерон-заместительной терапии обусловливает устранение большинства компонентов метаболического синдрома, прежде всего - висцерального ожирения. При этом у пациентов с более высокой степенью ожирения отмечается более выраженное снижение массы тела [36]. Метаболические хирурги предлагают рассматривать низкий уровень тестостерона в качестве показания для выполнения бариатрических операций [37]. Показано, что после выполнения хирургического вмешательства (обходной анастомоз желудка по Ру) повышается уровень общего тестостерона и глобулина, связывающего половые гормоны [38]. В метаанализе A. Singh [39] было продемонстрировано, что улучшение течения СД 2-го типа и в наблюдательных, и в рандомизированных клинических исследованиях отмечается более часто при проведении бариатрических операций. Между тем в нашем профильном наблюдательном исследовании при проведении терапевтической метаболической терапии были получены сопоставимые цифры вследствие обследования пациентов с СД 2-го типа и висцеральным ожирением при их сочетании с мужским гипогонадизмом. Безусловно, это связано с тем, что выборка пациентов, принимавших участие в российском исследовании, была смещенной, так как набор пациентов с СД 2-го типа осуществлялся в рамках амбулаторного приема эндокринологов-андрологов, специализирующихся на коррекции мужского гипогонадизма (рис. 3.17). Таким образом, у пациентов с СД 2-го типа, включенных в представленное нами исследование, коррекция мужского гипогонадизма при использовании тестостерон-заместительной терапии потенцировало сахароснижающий инкретиновый эффект инкретиномиметиков и предоставляло большинству пациентов возможность персонифицированного выбора между проведением бариатрического вмешательства и использования фармакологической терапии. Результаты данного наблюдательного исследования свидетельствуют о необходимости определения тестостеронового статуса у пациентов с СД 2-го типа и висцеральным ожирением, планирующих бариатрические вмешательства, и включения оценки тестостеронового статуса (общий тестостерон, глобулин, связывающий половые гормоны, простатоспецифический антиген, ультразвуковое исследование простаты) в стандартный алгоритм обследования пациентов, планирующих проведение бариатрического вмешательства (рис. 3.18). 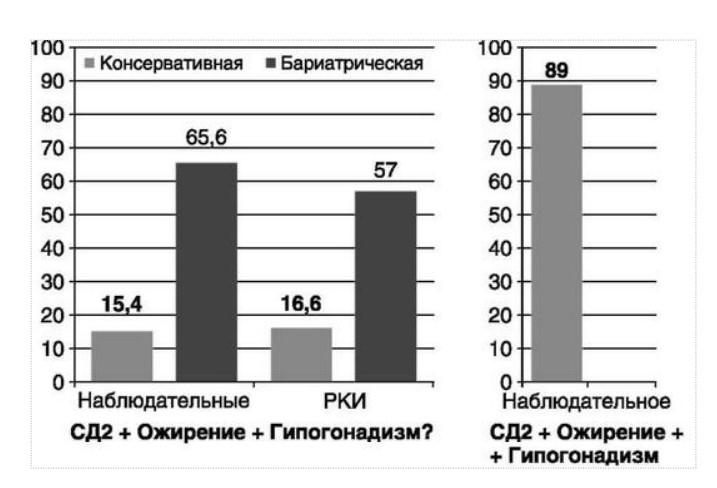 16Рис. 3.17. Эффективность метаболической терапевтической и хирургической терапии у пациентов с сахарным диабетом в наблюдательных и рандомизированных клинических исследованиях. Адаптировано согласно Ribaric G. и соавт. [40] Проблема индивидуального выбора наиболее приемлемого метода коррекции ожирения у пациента с СД 2-го типа приобретает все большее значение, учитывая расширение границ для проведения бариатрических вмешательств до 30 кг/м2 в случае неадекватного гликемическо-го контроля, согласно положениям гайдлайна DSS-II. Между тем у лиц азиатского происхождения в качестве отрезной точки рассматривается значение 27,5 кг/м2 [42]. Это позволяет прогнозировать значительное увеличение числа пациентов с СД 2-го типа, планирующих бариатрические операции. При этом эффективность ответа на проведение метаболической терапии инкретиномиметиками в сочетании с коррекцией мужского гипогонадизма приобретает ключевое значение при обосновании персонифицированного выбора метода коррекции массы тела. 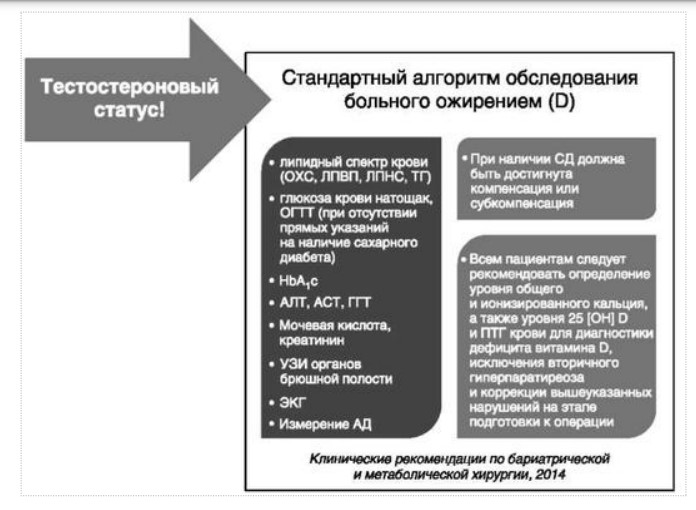 17Рис. 3.18. Необходимость оценки тестостеронового статуса у пациента с сахарным диабетом 2-го типа и висцеральным ожирением, планирующих бариатрические вмешательства. Адаптировано согласно [41] Необходимо отметить, что во всех представленных исследованиях использование тестостерон-заместительной терапии характеризуется высокой безопасностью, подтвержденной отсутствием статистически достоверно значимым увеличением уровня простатоспецифического антигена и объема предстательной железы. Назначение тестостерон-заместительной терапии ассоциируется с повышением качества жизни пациента, так как ассоциируется с уменьшением выраженности эректильной дисфункции (балльная оценка по опроснику МИЭФ-5) и симптомов, тестированных по опроснику AMS. ВЫВОДЫ • Проведение тестостерон-заместительной терапии у пациентов с СД 2-го типа, висцеральным ожирением и мужским гипогонадизмом характеризуется не только положительным метаболическим, но и мощным антиоксидантным эффектом, что характеризует снижение выраженности окислительного стресса, предотвращает формирование плохой метаболической памяти и может позволить предотвратить осложнения СД 2-го типа. • Фармакологическая коррекция мужского гипогонадизма у пациентов с СД 2-го типа сопровождается улучшением многочисленных параметров метаболического и тестостеронового статуса и должно быть включено в комплексную терапию СД 2-го типа. • Коррекция эректильной дисфункции при использовании тестостерон-заместительной терапии позволяет улучшить психическое состояние пациента с СД 2-го типа (уменьшить выраженность депрессивных состояний), в том числе - в группе пожилых пациентов. • У пациентов с СД 2-го типа, висцеральным ожирением и мужским гипогонадизмом в качестве критерия отбора для проведения бариатрических вмешательств может быть использована неэффективность ответа при проведении инкретиновой терапии и/или тестостерон-заместительной терапии. • У кандидатов на проведение бариатрической терапии должен быть исключен мужской гипогонадизм. При сочетании ожирения с СД 2-го типа и мужским гипогонадизмом большинству пациентов с позиций персонифицированной медицины может быть предоставлен выбор между бариатрической хирургией и консервативной терапией ожирения. • При сочетании СД 2-го типа с висцеральным ожирением у пациентов с мужским гипогонадизмом при отсутствии противопоказаний должна быть использована тестостерон-заместительная терапия. СПИСОК ЛИТЕРАТУРЫ 1. Dhindsa S., Miller M.G., McWhirter C.L. et al. Testosterone concentrations in diabetic and non-diabetic obese men // Diabetes Care. 2010. Vol. 33. P. 1186-1192. 2. Costanzo P.R., Knoblovits P. Male gonadal axis function in patients with type 2 diabetes // Horm. Mol. Biol. Clin. Investig. 2016. Vol. 26, N 2. P. 129-134. 3. Аметов А.С., Камынина Л.Л., Ахмедова З.Г. Глюкозо- и липотоксичность - взаимоотягощающие факторы при сочетании сахарного диабета типа 2 и ожирения // Врач. 2014. № 4. С. 21-23. 4. Rao P.M., Kelly D.M., Jones T.H. Testosterone and insulin resistance in the metabolic syndrome and T2DM in men // Nat. Rev. Endocrinol. 2013. Vol. 9, N 8. P. 479-493. 5. De Maddalena C., Vodo S., Petroni A., Aloisi A.M. Impact of testosterone on body fat composition // J. Cell. Physiol. 2012. Vol. 227, N 12. P. 3744-3748. 6. Grossmann M. Testosterone and glucose metabolism in men: current concepts and controversies // J. Endocrinol. 2014 Jan 27. Vol. 220, N 3. P. R37-R55. 7. Maejima Y., Kohno D., Iwasaki Y., Yada T. Insulin suppresses ghrelin-induced calcium signaling in neuropeptide Y neurons of the hypothalamic arcuate nucleus // Aging. 2011. Vol. 3. P. 1092-1097. 8. Wang W., Jiang T., Li C. et al. Will testosterone replacement therapy become a new treatment of chronic heart failure? A review based on 8 clinical trials // J. Thorac. Dis. 2016. Vol. 8, N 5. P. E269-E277. 9. Gak I.A., Radovic S.M., Dukic A.R. et al. Stress triggers mitochondrial biogenesis to preserve steroidogenesis in Leydig cells // Biochim. Biophys. Acta. 2015. Vol. 1853, N 10. Pt A. P. 2217-2227. 10. Blaya R., Thomaz L.D., Guilhermano F. et al. Total testosterone levels are correlated to metabolic syndrome components // Aging Male. 2016. Vol. 19, N 2. P. 85-89. 11. Vlachopoulos C., Pietri P, Ioakeimidis N et al. Inverse association of total testosterone with central haemodynamics and left ventricular mass in hypertensive men // Atherosclerosis. 2016. Vol. 250. P. 57-62. 12. Gencer B, Mach F. Testosterone: a hormone preventing cardiovascular disease or a therapy increasing cardiovascular events? // Eur. Heart J. 2015 Dec 5. pii: ehv439. [Epub ahead of print] 13. Ungureanu M.C., Costache I.I., Preda C. et al. Myths and controversies in hypogonadism treatment of aging males // Rev. Med. Chir. Soc. Med. Nat. Iasi. 2015. Vol. 119, N 2. P. 325-333. 14. Al-Khalil O. [Testosterone, a new «heart medicine»? or «Can I trust a new observational study?»] // Praxis (Bern 1994). 2015. Vol. 104, N 22. P. 1223-1224. 15. Wang C., Jackson G., Jones T.H. et al. Low testosterone associated with obesity and the metabolic syndrome contributes to sexual dysfunction and cardiovascular disease risk in men with type 2 diabetes // Diabetes Care. 2011. Vol. 34, N 7. P. 1669-1675. 16. Pye S.R., Huhtaniemi I.T., Finn J.D. et al. Late-onset hypogonadism and mortality in aging men. EMAS Study Group // J. Clin. Endocrinol. Metab. 2014. Vol. 99. P. 1357-1366. 17. Antonio L., Wu F.C., O'Neill T.W. et al. Associations between sex steroids and the development of metabolic syndrome: a longitudinal study in European men // J. Clin. Endocrinol. Metab. 2015. Vol. 100, N 4. P. 1396-1404. 18. Тишова Ю.А., Калинченко С.Ю. Роль коррекции гипогонадизма в лечении метаболического синдрома у мужчин и аспекты безопасности терапии препаратом тестостерона пролонгированного действия (результаты двойного слепого рандомизированного плацебоконтролируемого исследования) // Ожирение и метаболизм. 2010. № 26. С. 36-43. 19. Dikalov S. Crosstalk between mitochondria and NADPH oxidases // Free Radic. Biol. Med. 2011. Vol. 51, N 7. P. 1289-1301. 20. Kayama Y., Raaz U., Jagger A. et al. Diabetic cardiovascular disease induced by oxidative stress // Int. J. Mol. Sci. 2015. Vol. 16, N 10. P. 25 234-25 263. 21. Araki E., Nishikawa T. Oxidative stress: A cause and therapeutic target of diabetic complications // J. Diabetes Investig. 2010. Vol. 1, N 3. P. 90-96. 22. Aprioku J.S. Pharmacology of free radicals and the impact of reactive oxygen species on the testis // J. Reprod. Infertil. 2013. Vol. 14, N 4. P. 158-172. 23. Tiwari B.K., Pandey K.B., Abidi A.B., Rizvi S.I. Markers of oxidative stress during diabetes mellitus // J. Biomark. 2013. Article ID 378790. 24. Dohle G.R., Arver S., Bettocchi C. et al. Guidelines on Male Hypogonadism. European Association of Urology. 2015. 24 p. 25. Lunenfeld B., Mskhalaya G., Zitzmann M. et al. Recommendations on the diagnosis, treatment and monitoring of hypogonadism in men // Aging Male. 2015. Vol. 18, N 1. P. 5-15. 26. Testosterone Therapy in Men with Androgen Deficiency Syndromes: An Endocrine Society Clinical Practice Guideline. URL: http://press.endocrine.org/doi/ full/10.1210/jc.2009-2354#sthash.4eAH3JZ6.dpuf 27. ISSM quick reference guide on testosterone deficiency on men. Version: September 2015. 8 p. 28. Дедов И.И., Мельниченко Г.А., Роживанов Р.В., Курбатов Д.Г. Рекомендации по диагностике и лечению гипогонадизма (дефицита тестостерона) у мужчин. Проект // Пробл. эндокринол. 2015. Т. 61, № 5. C. 60-71. 29. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. 7-е изд. / под ред. И.И. Дедова, М.В. Шестаковой // Сахарный диабет. 2015. Спецвыпуск № 1. 112 с. 30. Cunningham G.R., Stephens-Shields A.J., Rosen R.C. et al. Association of sex hormones with sexual function, vitality, and physical function of symptomatic older men with low testosterone levels at baseline in the testosterone trials // J. Clin. Endocrinol. Metab. 2015. Vol. 100, N 3. P. 1146-1155. 31. Dan A., Chakraborty K., Mondal M. et al. Erectile dysfunction in patients with diabetes mellitus: its magnitude, predictors and their bio-psycho-social interaction: a study from a developing country // Asian J. Psychiatry. 2014. Vol. 7, N 1. P. 58-65. 32. Pietrzyk B., Olszanecka-Glinianowicz M., Owczarek A. et al. Depressive symptoms in patients diagnosed with benign prostatic hyperplasia // Int. Urol. Nephrol. 2015. Vol. 47, N 3. P. 431-40. 33. Ma B.O., Shim S.G., Yang H.J. Association of erectile dysfunction with depression in patients with chronic viral hepatitis // World J. Gastroenterol. 2015. Vol. 21, N 18. P. 5641-5646. 34. Тюзиков И.А., Калинченко С.Ю., Мартов А.Г. Андрогенный дефицит и соматические заболевания у мужчин: есть ли патогенетические связи // Земский врач. 2012. № 3. С. 12-14. 35. Corona G., Giorda C.B., Cucinotta D. et al. Sexual dysfunction at the onset of type 2 diabetes: the interplay of depression, hormonal and cardiovascular factors // J. Sex. Med. 2014. Vol. 11, N 8. P. 2065-2073. 36. Traish A.M. Testosterone and weight loss: the evidence // Curr. Opin. Endocrinol. Diabetes. Obes. 2014. Vol. 21, N 5. P. 313-322. 37. Samavat J., Facchiano E., Lucchese M. et al. Hypogonadism as an additional indication for bariatric surgery in male morbid obesity? // Eur. J. Endocrinol. 2014. Vol. 171, N 5. P. 555-560. 38. Sarwer D.B., Spitzer J.C., Wadden T.A. et al. Sexual functioning and sex hormones in men who underwent bariatric surgery // Surg. Obes. Relat. Dis. 2015. Vol. 11, N 3. P. 643-651. 39. Singh A.K., Singh R., Kota S.K. Bariatric surgery and diabetes remission: Who would have thought it? // Indian J. Endocrinol. Metab. 2015. Vol. 19, N 5. P. 563-576. 40. Ribaric G., Buchwald J.N., McGlennon T.W. Diabetes and weight in comparative studies of bariatric surgery vs conventional medical therapy: a systematic review and meta-analysis // Obes. Surg. 2014. Vol. 24, N 3. P. 437-455. 41. Клинические рекомендации по бариатрической и метаболической хирургии. М., 2014. 41 с. 42. Rubino F., Nathan D.M., Eckel R.H. et al. Metabolic surgery in the treatment algorithm for type 2 diabetes: a joint statement by international diabetes organizations // Diabetes Care. 2016. Vol. 39, N 6. P. 861-877. |
|
|
|
