|
Лекция 17. Дефицит андрогенов у мужчинДата: 01.08.2016 Источник: ИЗБРАННЫЕ ЛЕКЦИИ ПО ЭНДОКРИНОЛОГИИ Учебное пособие Участники: А.С. Аметов, Л.Ю. Моргунов, Е.Ю. Пашкова, О.А. Рождественская вернуться к медиатеке скачать интервью в txt формате скачать интервью в pdf формате  Лекция 17 ДЕФИЦИТ АНДРОГЕНОВ У МУЖЧИН А.С. Аметов, Л.Ю. Моргунов, Е.Ю. Пашкова, О.А. Рождественская 17.1. История развития андрологии Демографические процессы, происходящие в обществе, говорят об увеличении численности мужского населения пожилого возраста. За последние 100 лет число мужчин в мире в возрасте 65 лет увеличилось в 7 раз, а в возрасте старше 85 лет — в 31 раз. По данным Генерального секретаря ООН, средняя продолжительность жизни в развитых странах увеличилась в 20-м столетии с 49 до 79 лет. К началу XX в. мировая популяция составила 1,65 млрд человек, а XXI в. встретили 6,2 млрд жителей Земли. Растет и число мужчин, особенно пожилых, число которых, по прогнозам ООН, к 2010 г. составит в Китае около 11% от общей популяции, в Европейском сообществе — 20%, в США — 16%, в Японии — 26%. Материалы Токийского манифеста 2002 г. говорят об увеличении к 2050 г. числа пожилых людей до 14,7% от всего населения планеты, а это означает, что возрастет и количество ассоциированных с возрастом заболеваний. Несмотря на увеличение численности пожилых мужчин, средняя продолжительность их жизни остается ниже, чем у женщин. В Азии и Африке мужчины живут на 3 года меньше, чем женщины, в Северной Америке — на 7 лет, в Европе — на 8 лет, а в России — на 12 лет. Наука о мужском здоровье зародилась не сразу. Основу этой нау ки положили эскулапы древности. До нас дошли несколько их трудов о сохранении здоровья и молодости мужчин. Поиски средств сохранения здоровья мужчин предпринимались в Древнем Китае, Индии, Греции, Египте, великими цивилизациями Центральной и Южной Америки. В самом старом китайском медицинском труде «Ней Кине» (4 тыс. лет до н.э.) имеется множество рассуждений о здоровье мужчин. Гиппократ (460–377 гг. до н.э.) в своих «Афоризмах» и Аристотель в трактатах «О молодости и старости» пытались выяснить причины старения и рекомендовали различные варианты здорового образа жизни мужчин. Плиний-старший (Гай Плиний Секунд), живший в I в. н.э., рекомендовал употребление тестикул животных для увеличения сек суальной силы. Таким образом, первый камень в зарождающуюся науку о здоровье мужчин был заложен. Еще в Древнем Китае ученые пытались изучить влияние половых гормонов на поведение и образ жизни человека. Чэнь Цанци, живший в эпоху правления династии Тан, в своем труде «Бэньцаошии» (725) описывал свойства плаценты, богатой женскими половыми гормонами, и предлагал использовать ее для лечения ряда заболеваний. Позже, уже в XIV в., Чжу Чжэньхэн предлагал лечение многих заболеваний с помощью ткани плаценты. В 1378 г. Цзуци объяснял рост волос на лице мужчин (бороду и усы) «проявлением могущества мужского семени». В 1575 г. в книге «Лейюань» Ван Шичжэнь подметил, что «борода имеет отношение к почкам и яичкам». В 1596 г. в труде «Бэньцао ганму» Ли Шичжэнь рассказывал о многочисленных препаратах, которые изготавливались из ткани яичек, взятой у кабанов, кобелей или баранов. Эти препараты предназначались для излечения таких мужских заболеваний, как половое бессилие, сперматорея, гипогонадизм, импотенция и т.д. В Европе дальнейшие исследования мужского здоровья продолжились намного позже. В XIII в. Теофил Броди (1722–1776), наблюдая выпадение функций половых желез мужских и женских кастратов, пришел к выводу, что каждый орган в теле человека является источником некоей специфической субстанции, поступающей в кровь и оказывающей влияние на весь организм. Таким образом, Броди стал одним из первых, кто высказал мнение о гуморальной регуляции некоторых функций организма. В 1849 г. немецкий физиолог Адольф Бертольд впервые установил, что пересадка кастрированному петуху в брюшную полость семенников другого петуха приводит к восстановлению исходных свойств и функций у кастрированного петуха. В результате проведенных экспериментов было доказано, что гормоны, продуцируемые пересаженными яичками, оказывали непосредственное влияние на весь организм. К сожалению, столь важные для медицины открытия прошли мимо внимания ученого медицинского общества, исследования же в скором времени были преданы забвению. Спустя годы эти дан ные вновь появились на свет, и интерес к проблеме гормональной регуляции мужского здоровья возрос вновь. В 1855 г. благодаря исследованиям французского физиолога и врача Клода Бернара были изложены принципы внутренней секреции, а в 1889 г. стали гово рить о выделении в кровь клетками организма особых активных химических веществ, называемых гормонами, к которым относятся и андрогены. Полагают, что основоположник заместительной терапии андрогенами — французский физиолог и невролог Чарльз Эдуард Броун-Секар (1817–1894). Им была предложена идея о том, что нарастающая слабость стареющего мужчины вызвана снижением функ ции яичек. Ученый начал производить экстракты из кроличьих и бычьих семенников. Затем Броун-Секар перешел на изготовление экстракта из семенников морской свинки и собаки. Удаляя у этих животных половые железы, он сразу же растирал их в небольшом количестве воды, затем фильтровал и впрыскивал себе под кожу бедра. Однако впрыскивание было чрезвычайно болезненным, и ощущение мучительной боли сохранялось по нескольку дней. Его друг и соратник, небезызвестный физиолог и физик д’Арсонваль, предложил видоизменить способ приготовления экстракта: к получившемуся экстракту добавлялась столовая ложка глицерина и три столовые ложки дистиллированной воды с последующей фильтрацией. Начиная с 1892 г. дистиллированная вода заменялась ученым на морскую, что свело на нет все болевые ощущения. В 1889 г. 71-летний Броун-Секар доложил о проведенном на самом себе опыте Парижской Академии наук: «8 Апреля мне исполнилось 72 года. Мое общее состояние, которое ранее было превосходным, в течение последних 10–12 лет изменилось: с годами оно постепенно, но весьма значительно ухуд шилось. До того как я начал делать себе впрыскивания, я был вынужден садиться уже после получасовой работы в лаборатории. Но даже если я работал сидя, то через 3 или 4 ч, а иногда уже через 2 ч был без сил. Когда я, проработав таким образом несколько часов в лаборатории, вечером приезжал домой, то (и это продолжалось уже несколько лет) был настолько утомлен, что вскоре после легкого обеда должен был ложиться в постель. Иногда я был обессилен настолько, что, несмотря на сильное желание спать, которое мне не давало даже прочитать газету, засыпал только через несколько ча сов. На 2-й и особенно на 3-й день после начала впрыскиваний все изменилось, и ко мне возвратились, по крайней мере, все те силы, какими я обладал много лет ранее. Научная работа в лаборатории в настоящее время очень мало утомляет меня. К большому удивлению ассистентки, я могу теперь часами работать стоя, не чувствуя потребности сесть. Бывают дни, когда я после 3- или 4-часовой работы в лаборатории сижу после ужина более полутора часов над своими научными трудами, хотя я не делал этого в течение последних 20 лет. Я теперь могу, не напрягаясь и не думая об этом, чуть ли не бегом подниматься и спускаться по лестнице, как делал до 60 лет. На динамометре я установил несомненное увеличение своей мышечной силы. Так, после двух первых впрыскиваний сила мышц предплечья возросла на 6–7 кг сравнительно с прежним состоянием. У меня значительно улучшились также пищеварение и выделение шлаков, хотя количество и состав пищи, ежедневно принимаемой мной, не изменились. Умственный труд для меня теперь также значительно легче, чем был в течение ряда лет, и я в этом отношении наверстал все утраченное мною». Таким образом, Броун-Секар провел на самом себе первый опыт гормонотерапии с лечебной целью. Результаты исследований были опубликованы в журнале Lancet. Экстракты из семенников Броун-Секар назвал «эликсиром молодости». Шумиха, поднятая прессой вокруг создания «омолаживающего экстракта», привела к необычайному спросу на появившейся в продаже «Броун-Секаровской жидкости», за которой ломились пожилые французы, жаждущие возврата к прежней жизни. Однако временная стимуляция сменялась нарастающей слабостью и увяданием. Тогда еще не знали, что заместительная терапия должна быть постоянной, эти знания пришли позже, поэтому труды Броун-Секара были забыты на 40 лет. В дальнейшем труды Броун-Секара стали фундаментом для более масштабных исследований по введению экстракта тестикул животным и людям. В 1927 г. профессор кафедры химии Чикагского университета Фред С. Кох со своим студентом Лемюэлем Мак Ги получил 20 мг тестостерона из 40 фунтов ткани яичек крупного рогатого скота и ввели его кастрированным крысам, петухам и свиньям, у которых наступила ремаскулинизация. Процесс выделения и синтеза тестостерона проходил достаточно медленно, так как его молекулы имеют весьма сложное строение. Лишь в 1934 г. работа Эрнста Лакера увенчалась успехом. Удалось выделить кристаллический мужской гормон из тестикул быка. Однако промышленное производство тестостерона было невозмож но, пока этим не заинтересовались крупнейшие фармацевтические компании — Schering (Германия), Organon (Нидерланды) и Ciba (Швейцария), которые в 30-х годах XX в. приступили к полномасштабным исследованиям половых стероидов и программам их медицинского применения. В 1931 г. немецкий биохимик Адольф Фридрих Иоганн Бутенандт выделил из мочи человека андростерон и дегидроэпиан дростерон, изучил их химическое строение, осуществил синтез мужского полового гормона тестостерона, а в 1934 г. получил в чистом виде гормон желтого тела — прогестерон. Ученый установил наличие одинаковой структуры в молекулах всех трех гормонов. Такую структуру позже стали называть стероидной. Через некоторое время швейцарские химики Л. Ружичка и А. Веттштейн объявили о синтезе тестостерона из холестерина. Тестостерон же в кристаллической форме был получен из семенников быка лишь в 1935 г. (всего 10 мг тестостерона из 100 кг ткани). А в 1939 г. Ружичка и Бутенандт стали лауреатами Нобелевской премии за открытие метода синтеза тестостерона из холестерина. Далее через год в мировую практику вошел первый андроген — те стостерона пропионат. Так наступила эпоха препаратов андрогенов, а период начала 1930-х — середины 1950-х годов был назван «золотым веком стероидной химии». Исследования «золотого века» доказали, что соли тестостерона могут применяться не только как адекватная заместительная терапия дефицита андрогенов, но и служить мощным стимулятором мышечной силы и качества жизни. Началось повсеместное применение препаратов, содержащих тестостерон. Например, в быв шем СССР ученые установили, что тестостерон влияет не только на появление вторичных половых признаков, но и на синтез белка в организме. В 1940-х годах советские спортсмены активно использовали инъекции тестостерона (метандростенголона) в качестве анаболика для увеличения своих силовых показателей. В первой половине прошлого столетия в Гримальди работал русский исследователь, известный эндокринолог и хирург Сергей (Самуил) Абрамович Воронов. Он родился недалеко от Воронежа 10 июля 1866 г. По окончании Воронежского реального училища переселился в Париж, где окончил сначала факультет естественных наук в Сорбонне, а потом Ecole de Medecine в 1893 г. В течение 12 лет с 1897 г. работал в качестве хирурга в египетских госпиталях. С.А. Воронов был учеником французского биолога, хирурга, евге ниста Алексиса Карреля — лауреата Нобелевской премии по физиологии и медицине, от которого он получил знания по методике хирургической пересадки органов. С 1896 по 1910 г. С.А. Воронов работал в Египте, где изучал последствия кастрации на евнухах — исследования, давшие начало его трудам по влиянию гормонов на омоложение мужчины. Он экспериментировал с пересадкой яичек казненных преступников пожилым мужчинам, а в дальнейшем использовал ткань с яичек обезьян. С.А. Воронов жил в организованном им специальном центре и носившим название «Замок обезьян», где проводил свои необычные по тем временам эксперименты по ксенотрансплантации. С.А. Воронов получил известность за методику прививания ткани яичек обезьян к человеческим яичкам, которую он разработал во Франции в 1920–1930-х годах и которая составила его финансовое благополучие. Ученый пытался открыть генетическую формулу, которая позволила бы замедлить процессы старения. Другим направлением его работ был поиск путей повышения потенции у мужчин с помощью вытяжек, полученных из организма самцов-горилл. С.А. Воронов пробовал себя и в трансплантации органов. Его перу принадлежат несколько серьезных научных работ, среди которых «Пересадка половых кле ток от обезьяны человеку». Результатом экспериментов С.А. Воронова стала книга «О продлении жизни», изданная в 1923 г. Первую официальную пересадку «желез обезьяны» человеку он провел 12 июня 1920 г. Тонкие срезы (шириной в несколько миллиметров) яичек от шимпанзе и бабуинов исследователь пересадил в мо шонку пациента, тонкость образцов ткани позволила ей срастись с человеческой тканью. В своей книге «Омоложение прививанием», опубликованной в 1925 г., С.А. Воронов описал эффекты своих операций. Так, автор отмечал повышение сексуального влечения, улучшение памяти, возможность работать долгое время без отдыха, отпадение потребности в очках (из-за укрепления глазных мышц) и увеличение продолжительности жизни (к слову, сам Воронов прожил 85 лет). За 20–30-е годы более полутысячи мужчин прошли лечение по его методике в одной только Франции, а более 3 тыс. — в его алжирской клинике. С.А. Воронов пытался пересадить обезьяний яичник женщинам, и наоборот, проводил эксперименты по искусственному осеменению обезьяны спермой человека. Из-за известности своих операций С.А. Воронов послужил прототипом профессора Преображенского в повести Михаила Булгакова «Собачье сердце». С 1917 по 1926 г. С.А. Воронов провел более пятисот пересадок яичек молодых баранов и быков старым. В результате этих экспериментов у «пожилых» животных наблюдали резвость и игривость. А когда стало известно, что яички секретируют тестостерон, С.А. Воронов полагал, что его введение окажет несомненное омолаживающее действие. Однако в то время эксперименты этого ис следователя потерпели фиаско и были прекращены. Лишь в конце 90-х годов XX в. была показана безусловная перспективность тру дов С.А. Воронова. Для изучения мужского здоровья в 1997 г. в Великобритании было создано Международное общество по изучению проблем пожилых мужчин (ISSAM), хотя занимается оно вопросами здоровья мужчин начиная с 30-летнего возраста. Общество ставит своей целью поощрение врачей и других медицинских работников и за дачей понять суть заболеваний мужчин в контексте осознания процесса старения в целом и принятия междисциплинарного подхода к заботе о больных мужского пола. В частности, цель ISSAM: про движение концепции «здорового старения». В России уже с 20-х годов прошлого века андрология разви валась уже не как отдельное направление медицины, а как часть урологии. И как правило, лечение мужских расстройств осуществлялось исключительно врачами-урологами в урологических отделениях больниц. Позже, в 70-х годах XX в., в нескольких медицинских учреждениях России были созданы отдельные специализированные андрологические центры. В настоящее время, к сожалению, в России наблюдается серьезный дефицит специалистов-андрологов. Важнейшим шагом к преодолению этой проблемы стало создание Профессиональной ассоциации андрологов России (ПААР), аналогично с уже существующими организациями в США и Европе, что, бесспорно, призвано повысить профессиональный уровень отечественной андрологии. Количество действительных членов ПААР насчитывает более 800 врачей различных специальностей (урологи, хирурги, дерматовенерологи, сексопатологи, эндокринологи) из всех регионов России и стран СНГ. ПААР ежегодно проводит конгрессы, симпозиумы, мастер-классы. Официальный печатный орган ПААР научно-практический рецензируемый междисциплинарный журнал «Андрология и генитальная хирургия» регулярно выходит с 2000 г. В 90-х годах XX в. отмечен очередной всплеск внимания к проблемам стареющих мужчин. В ассоциациях эндокринологов, урологов и андрологов началась дискуссия о существовании мужского эквивалента женской менопаузы. Как известно, в отличие от женщин, у мужчин не наблюдается резкого окончания репродуктивной функции. Тем не менее в настоящее время общепризнанно, что у мужчин происходит постепенное снижение уровня половых гормонов, начало которого приходится на возраст 30–40 лет и неуклонно прогрессирует с возрастом. И если не возникает сомнений в необходимости заместительной гормональной терапии у жен щин, концепция подобного лечения у мужчин принимается с известным скепсисом. 17.2. Синтез и механизм действия тестостерона Тестостерон — основной мужской половой гормон, синтезируется в клетках Лейдига яичка, суточная продукция у взрослого мужчины в норме составляет 5–7 мг. Синтез тестостерона контролируется гипоталамическими и ги пофизарными гормонами. Гонадотропин-рилизинг-гормон стимулирует секрецию гонадотропинов — лютеинизирующего горомона и фолликулостимулирующего гормона (ФСГ) гипофизом. Продукция ГнРг происходит в аркуатном ядре и преоптической области гипоталамуса и находится под контролем нейротранс-миттеров: дофамин, серотонин и гамма-аминомасляная кислота оказывают ингибиторный эффект, а нейропептид Y — стимули рующий. ГнРг вырабатывается в импульсном режиме, его пиковая концентрация фиксируется каждые 90–120 мин, период полужизни составляет не более 5–10 мин. Попадая в портальную систему гипофиза, ГнРг связывается со своим рецептором на гонадотрофах и в зависимости от высоты и частоты пиков регулирует секрецию лютеинизирующего гормона и ФСГ. α-Адренергические импульсы оказывают стимулирующее влияние на продукцию ГнРг, β-адренергические, дофамин и эндорфины — подавляющее. Тестостерон и прогестерон замедляют пульсовой ритм, преимущественно через действие β-эндорфинов. Хорошо известно отрицательное воздействие стресса на репродуктивную систему, которое осуществляется за счет нескольких механизмов: повышение кортикотропин-рилизинг-гормона, который подавляет секрецию ГнРг путем прямого нейронального контакта между паравентрикулярным ядром и преоптической областью; повышение пролактина, снижающего частоту пиков секреции ГнРг. Пульсирующий ритм секреции необходим для стимуляции продукции гонадотропинов. Непрерывное введение ГнРг приводит к прекращению секреции гонадотропинов за счет down-регуляции ГнРг-рецепторов. Введение длительно действу ющих аналогов ГнРг используется в терапии таких заболеваний, как преждевременный пубертат, карцинома предстательной железы, эндометриоз (у женщин). Полипептиды лютеинизирующего гормона и ФСГ представляют собой крупные гликопротеиновые молекулы, схожие по структуре с ТТГ и хорионическим гонадотропином человека (ХГЧ). Их общей характеристикой является нековалентное связывание двух пептидных цепей (α и β) в гетеродимеры, при этом α-цепь одинакова у всех четырех гормонов, а биологический эффект зависит от свойств β-цепи. Лютеинизирующий гормон и ХГЧ практически идентичны по структуре и биологическому действию. Для всех гликопротеиновых гормонов характерно гликозилирование (связывание аспарагиновой кислоты в определенных участках пептидной цепи с углеводной цепью). Структура углеводного остатка может варьировать и в зависимости от структуры углевода у человека выделяют семь различных вариантов лютеинизирующего гормона. От углеводной цепи зависят третичная структура белка, его период полужизни в системном кровотоке, передача внутриклеточного сигнала после связывания с рецептором клетки-мишени. Высокое содержание сиаловой кислоты замедляет метаболизм гликопротеинов в печени и почках и продлевает, таким образом, его период полужизни. За счет присутствия сиаловой кислоты в конце углеводной цепи ТТГ и ХГЧ их период полужизни значительно больше, чем у лютеинизирующего гормона (3 ч, 5 ч и 20 мин соответственно). Лютеинизирующий гормон связывается со специфическим рецептором на поверхности клеток Лейдига, что приводит к повышению концентрации холестерина внутри клетки и запускает экспрессию генов ферментов стероидогенеза, в частности ключе вого фермента 20,22-десмолазы. Таким образом, начинается процесссинтезатестостерона. Отрицательная обратная связь осуществляется не только тестостероном, но и его метаболи том эстрадиолом. Тестостерон подавляет продукцию ГнРг и прак тически не влияет на секрецию лютеинизирующего гормона, в то время как эстрадиол оказывает ингибиторное действие как на гипоталамус, так и на гипофиз. ФСГ связывается с рецептором на клетках Сертоли и запускает процесс сперматогенеза. Помимо этого, от ФСГ зависит активность фермента ароматазы в клетках Сертоли. Также под действием ФСГ в клетках Сертоли синтезируются белковые гормоны активин и ингибин. Ингибин представляет собой гетеродимер, состоящий из α- и β-цепей. Существует две разновидности β-цепей (βα и ββ). Гетеро и гомодимеры β-цепей называются активин А (βα-ββ) и активин В (ββ-ββ). Ингибин является важнейшим звеном отрицательной обратной связи в контроле продукции ФСГ. При изолированном поражении клеток Сертоли дефицит ингибина приводит к повы шению ФСГ, при этом лютеинизирующий гормон остается в пределах нормальных значений (рис. 17.1). Тестостерон и эстрогены также оказывают подавляющее действие на продукцию ФСГ через отрицательную обратную связь. Исходным субстратом для производства тестостерона служит холестерин, который синтезируется непосредственно в клетках Лейдига, захват холестерина из циркулирующей крови минима- 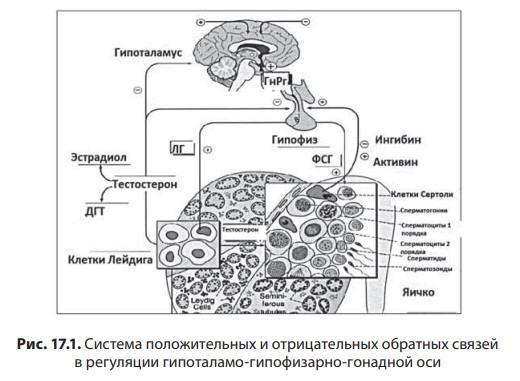 2Рис. 17.1. Система положительных и отрицательных обратных связей в регуляции гипоталамо-гипофизарно-гонадной осилен. Холестерин запасается в форме эфиров в жировых вакуолях клеток Лейдига и проходит пять энзиматических превращений, прежде чем становится С-19 тестостероном. Наиболее важный этап этой энзиматической цепи — превращение холестерина в прегненолон — находится под контролем лютеинизирующего гормона. Дальнейшее превращение прегненолона может идти по одному из двух путей, в зависимости от количества ферментов, конкурирующих за этот субстрат. D4-путь ведет к образованию прогестерона, D5-дегидроэпиандростерона и андростендиола (рис. 17.2). Представляя собой липофильный гормон, тестостерон легко проходит сквозь клеточные мембраны и покидает клетки Лейдига путем диффузии. В кровотоке 98% тестостерона находится в связанном с транспортными белками состоянии, только 2% — в свободной форме и являются биологически активным. Около 60% связано с глобулином, связывающим половые гормоны (ГСПГ) и 38% — с альбумином. 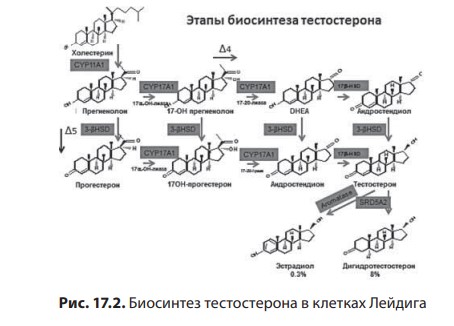 3Рис. 17.2. Биосинтез тестостерона в клетках Лейдига Глобулин, связывающий половые гормоны, — крупный гликопротеин массой 92,5 кДа, имеет два участка связывания для половых гормонов. Продукция его осуществляется в основном печенью, но в небольшом количестве он вырабатывается предстательной железой и молочными железами. Аффинитет ГСПГ к тестостерону выше, чем к эстрадиолу. Таким образом, при повышении продук ции ГСПГ печенью меняется соотношение между тестостероном и эстрадиолом в сторону снижения свободного тестостерона. Андрогены уменьшают продукцию ГСПГ и его уровень у мужчин всегда ниже, чем у женщин. Существует ряд состояний, влияющих на продукцию ГСПГ (табл. 17.1). Свободный тестостерон путем пассивной диффузии попадает в клетки-мишени, где он частично подвергается энзиматическому превращению в 5α-дигидротестостерон (ДГТ) при помощи фермента 5α-редуктазы или в 17β-эстрадиол при воздействии ароматазы. У человека выделено два изоэнзима 5α-редуктазы. Первый тип кодируется геном, локализованным на хромосоме 5, и экспрессирован в коже и печени. Второй тип кодируется геном, расположенном на хромосоме 2, и обнаруживается в предстательной железе, надпочечниках, семенных пузырьках, коже гениталий, волосяных фолликулах и коре головного мозга. Таблица 17.1 Факторы, влияющие на уровень ГСПГ 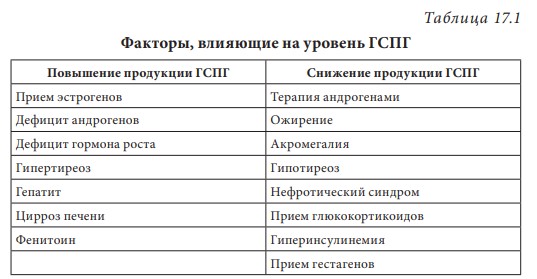 4Около 80% ДГТ образуется за счет периферической конверсии тестостерона, 20% секретируется непосредственно яичками. ДГТ и тестостерон связываются с одним и тем же андрогеновым рецептором, хотя аффинность ДГТ к рецептору примерно в 10 раз выше и диссоциация происходит медленнее. Таким образом, ДГТ облада ет большей андрогенной активностью. В физиологических концен трациях тестостерон и ДГТ дополняют друг друга. Кроме того, ежедневно за счет внетестикулярной ароматизации тестостерона и андростендиона образуется около 30 μг эстрадиола. Фермент ароматаза обнаруживается в жировой и костной ткани, предстательной железе. Около 10 μг эстрадиола в день вырабатывается клетками Лейдига. Эффекты тестостерона представлены на схеме 17.1. Катаболизм тестостерона и ДГТ происходит в печени и проходит два этапа. На первом этапе разрушается двойная связь между С4 и С5, на втором — происходит превращение липофильного стероида в водорастворимую молекулу за счет конъюгации с глюкуроновой кислотой или сульфатации по С3 или С17. Элиминация осуществляется с мочой в виде 17-кетостероидов или сульфатов (андростерона, этиохоланолона, эпиандростерона, эпитестостерона). Несмотря на связь с транспортными белками плазмы, элиминация тестостерона из сыворотки происходит быстро, период полу жизни свободного тестостерона не превышает 10 мин. Схема 17.1. Эффекты тестостерона: прямые и опосредованные его метаболитами 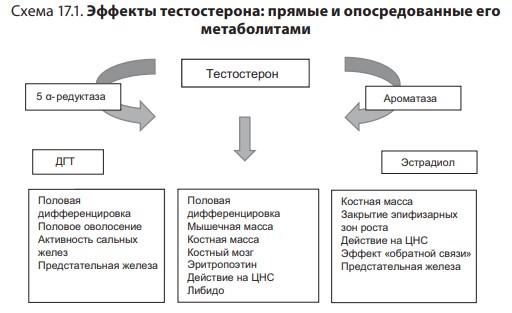 5Для понимания механизма действия андрогенов необходимо иметь представление о структуре и функции рецептора к андрогенам. Рецептор к андрогенам принадлежит к семейству рецепторов к стероидным и тиреоидным гормонам и кодируется 8 экзона ми (А-Н) гена, расположенного на длинном плече Х-хромосомы (Xq 11-12). Рецептор представляет собой полипептид из 910 аминокислот с молекулярной массой 98,5 кДа. Подобно другим рецеп торам этого семейства он относится к ДНК-связывающим белкам. Рецептор к андрогенам имеет три домена, каждый из которых несет свою функцию. Структура N-терминального сегмента (экзон А) подвержена существенным индивидуальным вариациям. Этот участок ответственен за формирование третичной и четвертичной структуры рецептора к андрогенам (рис. 17.3). В состав N-терминального сегмента входит глутаминовый по втор различной длины (в норме 8-35 повторов), который кодирует ся тринуклеотидом CAG в экзоне А гена андрогенного рецептора. Количество CAG-повторов влияет на транскрипторную активность рецептора. Чем больше повторов, тем ниже транскрипторная активность при стимуляции АР. Установлено, что, чем меньше количество CAG-повторов, тем прочнее связь андрогенов с рецептором к андрогенам. Увеличение количества CAG-повторов (более 38) ассоциировано с умеренной резистентностью к действию андрогенов и синдромом Кеннеди (дегенеративная бульбоспинальная моторная нейропатия). 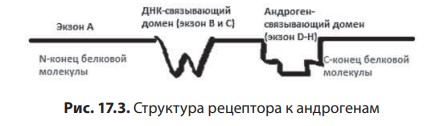 6Рис. 17.3. Структура рецептора к андрогенам Центрально расположенный гидрофильный ДНК-связывающий домен (кодируется экзонами В и С) имеет два «цинковых пальца», которые связываются со специфическими участками ДНК в андроген-чувствительных генах и, таким образом, влияют на транскрипцию. ДНК-связывающие участки рецепторов всех стероидных гормонов обладают высокой гомологичностью (40–90%), небольшие различия определяют генную специфичность рецептора. С-концевой фрагмент (экзоны D-H) содержит гидрофобный андрогенсвязывающий домен, с которым взаимодействуют ДГТ и тестостерон (см. рис. 17.3). Аминокислотная последовательность этого участка на 40–50% гомологична аминокислотной последовательности соответствующих участков гестагенных, минералокортикоидных и глюкокортикоидных рецепторов. При этом практически отсутству ет сходство с лигандсвязывающим доменом эстрогенного рецептора. Связывание тестостерона или ДГТ с рецептором к андрогенам запускает конформационные изменения, приводящие к активации этого рецептора. Активированные данные рецепторы формируют димеры и связываются со специфическим участком ДНК, называемым андрогенчувствительным элементом, распо ложенным в промотерной части андрогенчувствительных ге нов. Первый «цинковый палец» ответственен за специфичность связывания с участком ДНК, второй стабилизирует связь между рецептором к андрогенам и ДНК. Последняя связь запускает транскрипцию андрогенчувствительных генов. 17.3. Этиология мужского гипогонадизма Мужской гипогонадизм — клинический синдром дефицита андрогенов, развивающийся при повреждении одного или нескольких звеньев гипоталамо-гипофизарно-гонадной оси. В зависимости от уровня поражения выделяют:
Первичный (гипергонадотропный) гипогонадизм. У пациента с первичным гипогонадизмом при обследовании выявляются снижение уровня тестостерона, повышение гонадотропинов, нарушение сперматогенеза. Наиболее часто (1 на 500 мужчин) встречается синдром Кляйнфельтера (47,ХХY) и опухоли яичка (12 на 10 000 мужчин). Новообразования яичка — наиболее распространенное опухолевое заболевание у мужчин репродуктивного возраста. Другие причины первичного гипогонадизма приведены в табл. 17.2. Вторичный (гипогонадотропный) гипогонадизм. К наиболее частым причинам вторичного гипогонадизма относят гиперпролактинемию (идиопатическую, микро- и макропролактиномы, вследствие приема ряда лекарственных препаратов, хронической почечной недостаточности или гипотиреоза), изолированный гипогонадотропный гипогонадизм и синдром Каллмана (гипогонадотропный гипогонадизм с гипоосмией, распространенность 1:10 000 мужчин). Все эти нарушения обусловлены нарушением секреции или действия ГнРг, что приводит к снижению секреции лютеинизирующего гормона и ФСГ. При синдроме Каллмана в период внутриутробного развития происходит нарушение миграции ГнРг-секретирующих нейронов. Дифференциальный диагноз необходимо проводить с конституциональной задержкой пубертата, которая встречается у одного из 40 мужчин и связана с генетически обусловленным более поздним запуском пульсирующего ритма секреции ГнРг. В табл. 17.3 представлены более редкие причины вторичного гипогонадизма. Таблица 17.2 Причины первичного гипогонадизма 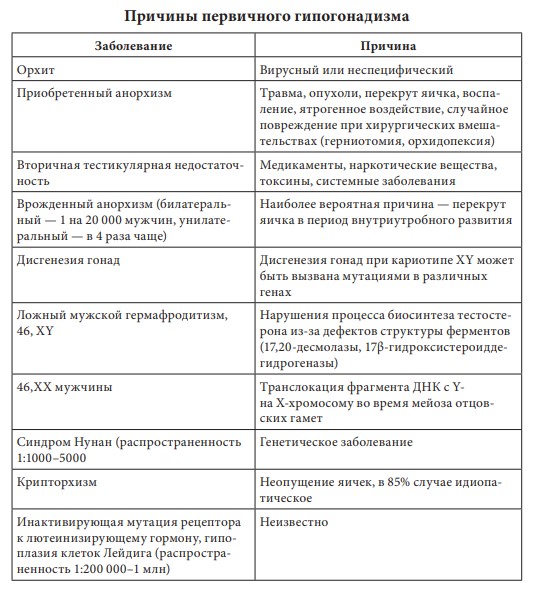 7 Гипогонадизм, обусловленный нарушениями на уровне ор ганов-мишеней. Это редко встречающиеся формы гипогонадизма. Обусловлены дефектами рецептора к андрогенам с минимальной, частичной (синдром Рейфенштейна, синдром Кеннеди) или полной (синдром тестикулярной феминизации) резистентностью к действию андрогенов, а также дефицитом 5α-редуктазы. Причиной считаются спорадические или наследственные мутации гена рецептора к андрогенам. На сегодня описано около Причины вторичного гипогонадизма Таблица 17.3 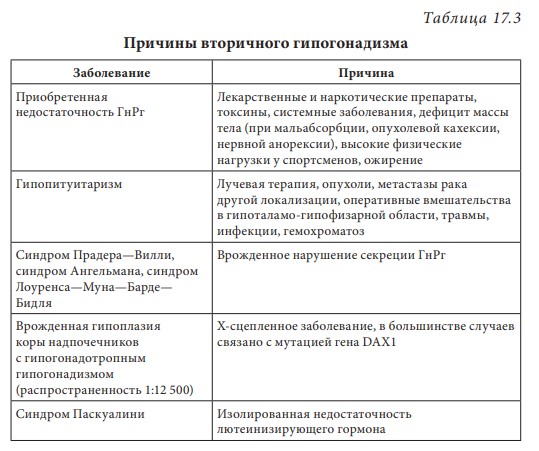 8 250 различных мутаций, 200 из них — в экзонах В-Н, содержащих андроген- и ДНК-связывающие участки и только 23 — в экзоне А. При этом мутации в экзоне А практически всегда приводят к полной нечувствительности рецептора к андрогенам, в то время как другие мутации сопровождаются незначительным снижением его функции. Увеличение количества полиглутаминовых последовательно стей (CAG-повторов) приводит не только к резистентности к действию андрогенов, но и к редкому неврологическому заболеванию, проявляющемуся прогрессирующей бульбоспинальной мышечной атрофией (синдром Кеннеди). При синдроме Кеннеди прогрессирующая дегенерация моторных нейронов спинного мозга манифестирует в молодом и среднем возрасте. Резистентность к действию андрогенов клинически проявляется гинекомастией, бесплодием, эректильной дисфункцией. Тем не менее многие пациенты к моменту начала заболевания уже имеют детей и, таким образом, пере дают патологическое число CAG-повторов по наследству. 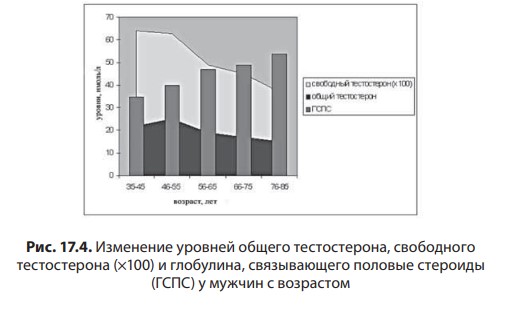 9Рис. 17.4. Изменение уровней общего тестостерона, свободного тестостерона (×100) и глобулина, связывающего половые стероиды (ГСПС) у мужчин с возрастом Дифференциальная диагностика других вариантов резистентности к андрогенам представлена в табл. 17.4. Сочетание гипогонадотропного гипогонадизма и недоста точности яичка. Возрастной дефицит андрогенов. Продукция тестостерона снижается с возрастом. Многочисленными исследованиями продемонстрирована обратная взаимосвязь между возрастом и уровнем тестостерона сыворотки крови. Между 40 и 70 годами количество биологически активного свободного тестостерона снижается примерно на 1 % в год. В то же время отмечается рост ГСПГ (рис. 17.4). В «Балтиморском исследовании ста рения»/Baltomore Aging Study (2002) у мужчин старше 60 лет (20% случаев) и 70 лет (30%), а также старше 80 лет (50%) определялся низкий уровень общего тестостерона. Если оценивать свободный тестостерон, то доля мужчин с гипогонадизмом будет еще выше. Уровень тестостерона варьирует и в различных поколениях. Исследование двух групп по 1 тыс. мужчин в возрасте 65–69 лет, проведенное в Бостоне, показало, что в течение последних двух десятилетий уровень тестостерона у них снизился в среднем с 503 нг/дл в 1988 г. до 423 нг/дл в 2004 г. Уровень эстрадиола также уменьшается с возрастом и является результатом снижения тестостерона, поскольку большая часть эстрадиола образуется в результате конверсии тестостерона. Таблица 17.4 Клинические симптомы различных форм резистентности к андрогенам 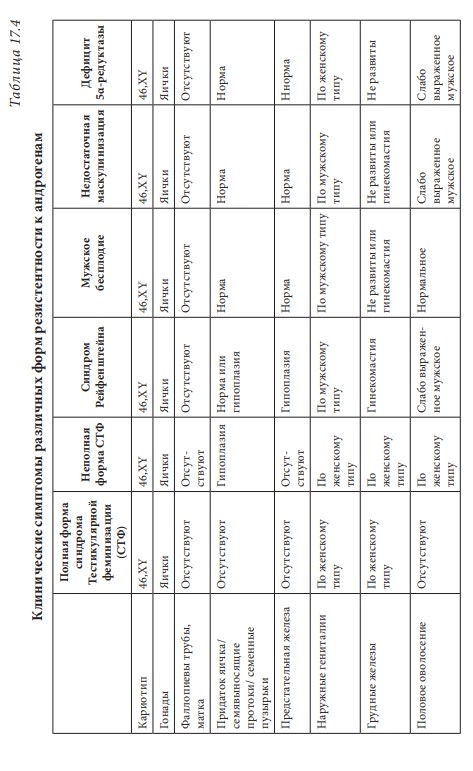 10  11Многие изменения, происходящие с возрастом, такие как уменьшение костной и мышечной массы, уменьшение роста волос на теле, снижение гемоглобина, ухудшение физической, умственной и половой активности, очень похожи на симптомы дефицита андрогенов при классических формах гипогонадизма у молодых мужчин. Поэтому можно предполагать, что существует прямая связь между возрастным снижением уровня андрогенов и симптомами старения. Для обозначения дефицита андрогенов у пожилых мужчин предлагался ряд терминов: андропауза, мужской климактерий, синдром частичного андрогенного дефицита пожилых мужчин/ partial androgen deficit in aging men (PADAM). Тем не менее все эти определения имели те или иные недостатки. Последнее время общепринятым в англоязычной литературе стал термин Late-Onset Hypogonadism (LOH) — возрастной гипогонадизм, или возрастной андрогенный дефицит. Изменения, приводящие к развитию возрастного андрогенного дефицита, возникают как на уровне гипоталамуса и гипофиза, так и в яичках. С возрастом секреция ГнРг снижается, что приводит к снижению амплитуды пиков лютеинизирующего гормона, составляя не более 50% от показателей молодого возраста. Помимо этого, исчезает суточный ритм секреции тестостерона. Если в молодом возрасте в утренние часы секреция тестостерона значительно повышается, а потом к вечеру снижается, то с возрастом утренний подъем тестостерона исчезает, и низкие вечерние значения определяются на протяжении суток. Продукция лютеинизирующего гормона сокращается не только из-за секреции ГнРг, которая уменьшается, но и вследствие того, что повышается чувствительность гонадотрофов к подавляющему действию тестостерона. Иначе говоря, для стимуляции продукции лютеинизирующего гормона необходимо более существенное снижение уровня тестостерона, чем в молодом возрасте. Помимо этого, сокращается количество клеток Лейдига и их ответ на стимуляцию лютеинизирующего гормона. По этим причинам типичными лабораторными признаками возрастного андрогенного дефицита считаются сниженный уровень тестостерона при нормальном уровне лютеинизирующего гормона. Многие хронические заболевания сопровождаются развитием дефицита андрогенов, поэтому существует однозначная взаимосвязь между уровнем тестостерона и общим состоянием здоровья. 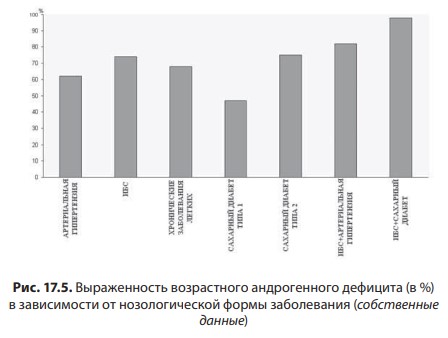 12Рис. 17.5. Выраженность возрастного андрогенного дефицита (в %) в зависимости от нозологической формы заболевания (собственные данные) Так, согласно проведенному в терапевтической клинике скринингу андрогенного статуса у пациентов с заболеваниями внутренних органов, гипогонадизм отмечается как распространенное состояние, прежде всего у больных с сосудистой патологией. Снижение уровня общего тестостерона, сопровождающееся клиническими симптомами дефицита андрогенов, отмечено у 45% пациентов с изолированной артериальной гипертонией, у 66,6% — при сочетании ишемической болезни сердца и артериальной гипертензией, у больных с сочетанием ишемической болезни сердца и СД 2 — в 70% случаев, а в группе пациентов с сочетанием диабета, ожирения и ишемической болезни сердца — в 100% (рис. 17.5). Курение и алкоголь также вносят негативный вклад в сроки развития андрогенного дефицита. Клиническая картина. При возрастном андрогенном дефиците наблюдают объективные соматические признаки и субъективное ощущение «нездоровья». Нельзя с уверенностью сказать, что все объективные и субъективные симптомы можно отнести на счет дефицита андрогенов. Тем не менее при сочетании нескольких типичных признаков можно заподозрить возрастной андрогенный дефицит (табл. 17.5). Таблица 17.5 Возрастные соматические изменения у мужчин 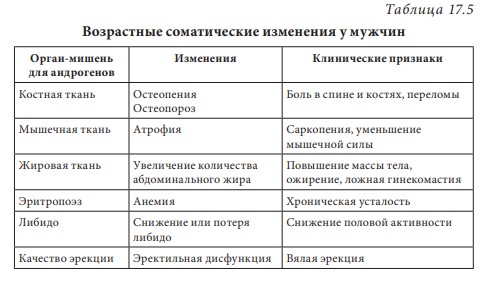 13Мужчины старше 50–60 лет часто испытывают все эти симптомы, которые воспринимаются как уменьшение «мужественности». Это приводит к психологическому дискомфорту и снижению качества жизни. Клинические признаки возрастного андрогенного дефицита варьируют от снижения массы мышечной ткани (саркопения) до мышечной атрофии с уменьшением мышечной силы и физической активности. В возрасте 70 лет тощая масса снижается в среднем на 12 кг, преимущественно за счет мышечных потерь. Эпидемиологические исследования показывают, что изменения состава тела начинаются с 30 лет. Тощая масса, которая определяется, как масса тела минус жировая масса, складывается из двух основных составляющих — мышечной массы и массы остальных органов и тканей. Мышечная масса уменьшается на 35–40% между 20 и 80 годами, а масса других органов и тканей остается неизменной с течением времени. Мышечная атрофия возникает из-за уменьшения количества и толщины мышечных волокон и одновременного снижения синтеза белка. Из-за уменьшения мышечной массы и силы пожилых мужчин беспокоят быстрая утомляемость, снижение толерантности к физическим нагрузкам. К тому же мышечная масса — одна из важных составляющих плотности костной ткани и частоты переломов. Помимо этого, серьезная мышечная атрофия приводит к невозможности человека самому обслуживать себя, вследствие чего он становится зависимым от посторонней помощи. Возрастной андрогенный дефицит нельзя считать единственной причиной саркопении. Дефицит анаболического действия гормона роста и ИФР-1 и низкая физическая активность также вносят свой «вклад». Несмотря на развитие саркопении, масса тела обычно увеличи вается за счет прироста жировой ткани на 18–36% преимуществен но в абдоминальной области. У мужчин прослеживается четкая связь между количеством интраабдоминального жира и уровнем тестостерона. Другим важным симптомом возрастного андрогенного дефицита следует считать снижение минеральной плотности костной ткани, приводящее к остеопении или остеопорозу. Клинически это проявляется болью в спине и переломами. Среди пациентов с переломом шейки бедра мужчины составляют 25–30%. Среди множества предрасполагающих к переломам факторов риска у мужчин лидирующее место занимают злоупотребление алкоголем, прием системных глюкокортикоидов и гипогонадизм. В двух исследованиях среди мужчин, проживающих в домах престарелых и имеющих перелом шейки бедра, снижение тестостерона определялось в 65% случаев, у не имеющих перелома — в 22%. В ряде крупных эпидемиологических исследований показана положительная корреляция между уровнем тестостерона и его метаболита эстрадиола и минеральной плотностью костной ткани в позвонках и шейке бедра. Таким образом, возрастной андрогенный дефицит относят к причине развития остеопении/остеопороза у пожилых мужчин. Эритропоэз также уменьшается с возрастом, количество эритроцитов и гемоглобина приближается к нижней отметке нормы. Снижение концентрации гемоглобина сопровождается снижением способности к транспорту кислорода в ткани. Это приводит к хронической усталости и усугубляет снижение физической активно сти, обусловленной саркопенией. Для большинства мужчин снижение либидо и половой активности являются основными субъективными симптомами возрастного андрогенного дефицита. Если мужчины в возрасте 30–40 лет имеют половые контакты в среднем 2–3 р/нед., то к 60 годам — не более 2 р/мес. По данным «Массачусетского исследования старения мужчин»/Massachusetts Male Aging Study, 35% мужчин старше 40 лет предъявляют жалобы на снижение эректильной функции и либидо, что сопровождается серьезным психологическим дискомфортом. Около половины мужчин в возрасте 60 лет страдают эректильной дисфункцией и около 15% абсолютно неспособны к половой жизни. Для оценки эректильной функции в клинической практике удобно использовать опросник МИЭФ-5 (табл. 17.6). Для возрастного андрогенного дефицита типична триада симптомов: уменьшение частоты утренних эрекций, снижение либидо, эректильная дисфункция. После подсчета баллов можно сделать заключение о степени выраженности эректильной дисфункции, при этом сумма баллов 21– 25 рассматривается как норма, 16–20 баллов — легкая эректильная дисфункция, 11–15 баллов — умеренная, 5–10 баллов — тяжелая. Сегодня мы рассматриваем эректильную дисфункцию как многофакторное заболевание. Такие сопутствующие заболевания как сахарный диабет, атеросклероз сосудов, хроническая почечная недостаточность, артериальная гипертензия, неврологические заболевания, прием ряда лекарственных препаратов могут влиять на формирование эректильной дисфункции. Также ее возникновению способствует дефицит андрогенов, который редко (не более чем в 10% случаев) отмечают как основную причину данного многофакторного заболевания. Распространенность дефицита андрогенов одинакова у мужчин с эректильной дисфункции и без нее, поэтому назначение препаратов тестостерона мужчине с данной дисфункцией и нормальным уровнем тестостерона не даст положительного клинического эффекта. Однако можно привести исследования, демонстрирующие существенное улучшение эректильной функции, либидо и удовлетворенности половой жизнью при компенсации существующего дефицита андрогенов. При метаанализе исследований, оценивающих эффективность терапии тестостероном эректильной дисфункции, показано, что применение тестостерона у мужчин с исходно низким его уровнем дает бÓльший процент успеха, чем плацебо. Нужно иметь в виду, что исследования были небольшими и плохо контролируемыми. Наибольшую эффективность в лечении эректильной дисфункции имеют ингибиторы фосфодиэстеразы типа 5 (иФДЭ-5), Таблица 17.6 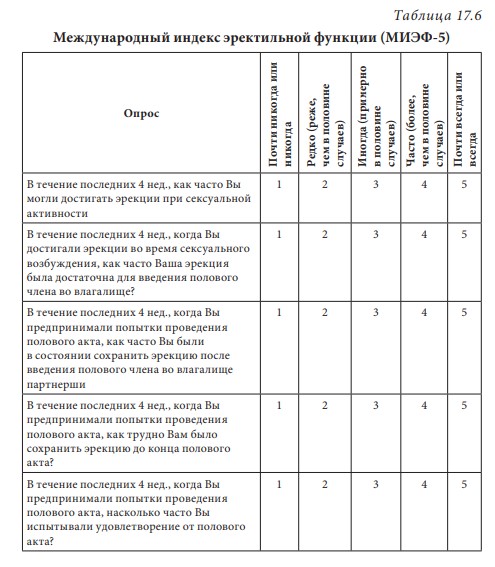 14Международный индекс эректильной функции (МИЭФ-5) помогающие 60–70% пациентов. Тем не менее треть пациентов не отвечают на терапию иФДЭ-5. Это именно те пациенты, которым для получения эффекта стоит дополнительно назначить препараты тестостерона. Применение трансдермальных форм тестостерона не только нормализует его уровень в крови, но и повышает скорость кровотока в пенильной артерии. Наблюдение, показавшее, что до бавление тестостерона у пациентов с неэффективностью монотерапии иФДЭ-5 способствует эффективному лечению эректильной дисфункции, нашло подтверждение во многих исследованиях. Наилучший эффект отмечен при назначении тестостерона мужчинам с СД 2 при отсутствии эффекта от иФДЭ-5. Не до конца изучено, связаны ли такие возрастные симптомы, как снижение способности к концентрации внимания, запоминанию, пониженный фон настроения с дефицитом андрогенов. Клетки головного мозга имеют рецепторы к андрогенам и экспрессируют ароматазу, таким образом, эстрадиол также является нейрогормоном. В Балтиморском исследовании старения (Baltimore Aging Study) показана связь между снижением уровня свободного тестостерона и когнитивными способностями. Тем не менее учитывая субъективность симптомов и отсутствие объективных методов оценки терапевтического эффекта тестостерона на когнитивную функцию, невозможно сделать однозначное заключение. По данным ряда исследований, андрогены способствуют улучшению настроения у молодых мужчин с классическими формами гипогонадизма. Также показано их положительное влияние при депрессии. Стоит учитывать, что депрессия может быть вызвана разными причинами, в частности, эректильной дисфункции, поэтому при восполнении дефицита тестостерона и улучшении данной функции можно ожидать и изменения по шкале депрессии. При дефиците андрогенов снижается продукция кожного сала, что делает кожу сухой и чувствительной к внешним воздействиям. Пациенты обращают внимание на уменьшение роста волос на теле. При возрастном андрогенном дефиците могут возникать типичные для женщин в перименопаузе жалобы на приливы и потливость, преимущественно ночную. Диагностика возрастного андрогенного дефицита. О лабораторной диагностике речь пойдет в соответствующем разделе. Здесь будет сделан акцент на удобном инструменте для сбора анамнеза — опроснике «Оценка выраженности симптомов»/Aging Male’s Symptoms (AMS). Этот опросник считается нужным, поскольку содержит необходимые для постановки предварительного диагноза возрастного андрогенного дефицита вопросы, которые пациенты и врачи не всегда готовы обсуждать. Также он удобен для оценки эффективности терапии во время лечения (табл. 17.7). Лекция 17. Дефицит андрогенов у мужчин Таблица 17.7 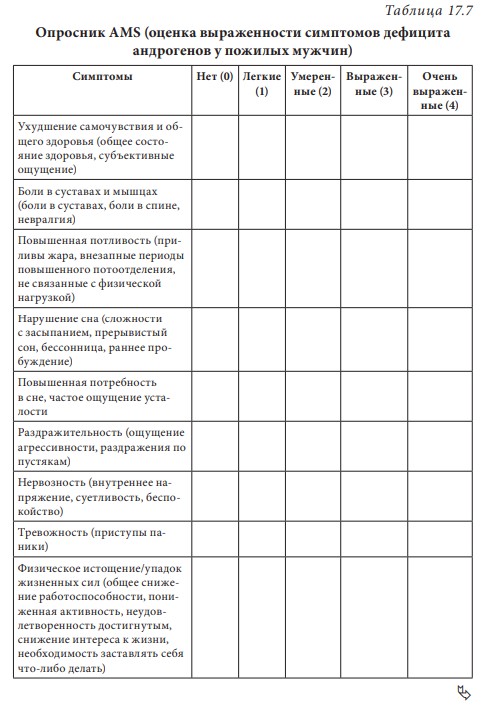 15 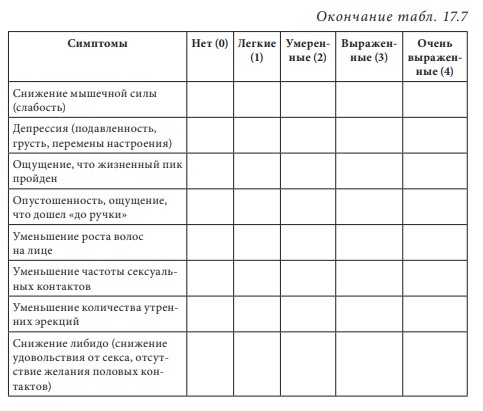 16Опросник AMS (оценка выраженности симптомов дефицита андрогенов у пожилых мужчин) 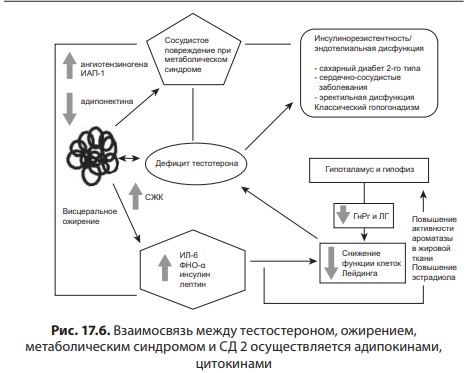 17Рис. 17.6. Взаимосвязь между тестостероном, ожирением, метаболическим синдромом и СД 2 осуществляется адипокинами, цитокинами висимой вазоконстрикцией и NO-зависимой вазодилатацией в сторону вазоконстрикции. Адипокины способствуют адгезии моноцитов и их миграции в сосудистую стенку, а также конверсии моноцитов в макрофаги. Фермент ароматаза, конвертирующий тестостерон в эстрадиол, широко экспрессирован в жировой ткани. У мужчин с ожирением часто определяется повышение уровня эстрогенов, которые, активируя гипоталамические эстрогеновые рецепторы, подавля ют гипоталамо-гипофизарно-гонадную ось (см. рис. 17.6). Лечение мужчин препаратами из группы ингибиторов ароматазы (наибольшее распространение эти препараты нашли в терапии гормонозависимого рака молочной железы) устраняет гипогонадотропный гипогонадизм при ожирении. Также у мужчин с ожирением и метаболическим синдромом отмечается сниженный ответ клеток Лейдига на стимуляцию экзогенным гонадотропином. Острый дефицит тестостерона уже через 2 нед. приводит к снижению чувствительности к инсулину без существенного влияния на состав тела. Эти данные свидетельствуют о прямом влиянии тестостерона на чувствительность к инсулину. Недавно с помощью клэмп-метода было показано, что взаимное влияние чувствительности к инсулину, триглицеридов и половых стероидов осуществляется практически моментально при изменении одного из этих параметров и не может быть связано с изменением состава тела. Повышение тестостерона и снижение эстрадиола в течение недели у молодых мужчин сопровождалось снижением уровня триглицеридов после приема пищи, повышением секреции глюкозозависимого инсулинотропного полипепти да и чувствительности к инсулину. Провоспалительные адипокины приводят не только к инсулинорезистентности, но и к эндотелиальной дисфункции, что повышает риск сердечно-сосудистых заболеваний и эректильную дисфункцию. Клиническое наблюдение, что эректильная дисфункция возникает чаще и раньше у мужчин с сахарным диабетом, подтверждено многими популяционными эпидемиологическими исследованиями. В исследовании Look Ahead (2009) у 49,8% мужчин с сахарным диабетом выявлена эректильная дисфункция от легкой и умеренной степени. Эректильная дисфункция в этом исследовании ассоциирована с возрастом (ОШ 1,05; 95% ДИ 1,01–1,10), уровнем гликированного гемоглобина (ОШ = 1,31; ДИ 1,05–1,63), артериальной гипертензией (ОШ = 2,41; ДИ = 1,34–4,36) и метаболическим синдромом (ОШ = 3,05; ДИ 1,31–7,11). На сегодняшний день крайне невелик перечень исследований, оценивающих распространенность снижения либидо у мужчин с диабетом. Снижение либидо чаще обусловлено наличием эректильной дисфункции и депрессии. По данным обсервационного исследования (2010), проведенного в Шри-Ланке и включавшее 253 мужчин с СД 2, после исключения из анализа мужчин с эректильной дисфункцией, распространенность сниженного либидо составила 25%. В другом исследовании, популяционном, прежде временная эякуляция встречалась у 36,3% мужчин с сахарным диабетом (95%; ДИ 26–48) и у 22,9% (95%; ДИ 18–28.6) без диабета. В Европейском исследовании старения мужчин (European Male Aging Study) (2010) на основании обследования 3369 мужчин в возрасте 40–79 лет выделили три основных симптома (слабая утренняя эрекция, снижение либидо и эректильная дисфункция), имеющих прочную взаимосвязь со сниженным уровнем тестостерона. Кроме того, в этом исследовании выявили, что у мужчин с ожирением, метаболическим синдромом и СД 2 низкий уровень тестостерона наблюдается намного чаще. При сравнении уровня тестостерона у пациентов с СД 2, с эректильной дисфункцией и без нее, выявили существенно более низкий уровень свободного тестостерона (р < 0,027) у пациентов с эректильной дисфункцией. При этом уровень общего тестостерона не различался, а тяжесть эректильной дисфункции коррелировала со степенью снижения тестостерона. При обследовании 1200 мужчин с эректильной дисфункцией, G. Corona и соавт. (2006) выявили у 16% пациентов СД 2. Снижение общего тестостерона ниже нормы (менее 10,4 нмоль/л выявлено у 24,5% пациентов с сахарным диабетом и только у 12,6% без диабета после поправки на возраст и ИМТ). Гипогонадизм у мужчин с сахарным диабетом ассоциирован с более низким уровнем лютеинизирующего гормона и большим количеством симптомов депрессии. Ранее в генезе эректильной дисфункции при сахарном диабете признавали ведущую роль автономной нейропатии или облитерирующего поражения сосудов, последние исследования демонстрируют, что наиболее ранним и лучше всего поддающимся терапии дефектом можно считать эндотелиальную дисфункцию. Исследования, проведенные на животных моделях, демонстрируют эффекты тестостерона на нервную проводимость, активность NO-синтетазы, дифференцировку и рост гладкомышечных волокон, которые обеспечивают эрекцию. Провоспалительные цитокины, в избытке присутствующие при ожирении и дефиците андрогенов, приводят к эндотелиальной дисфункции. У мужчин с СД 2 могут быть и другие причины эректильной дисфункции. Так, в исследовании (2000) 8373 мужчин с СД 2 эректильная дисфункция была ассоциирована с плохим метаболическим контролем, курением, злоупотреблением алкоголем, приемом антидепрессантов, гипотензивных препаратов и блокаторы Н2-гистаминовых рецепторов. 17.4. Диагностика гипогонадизма Пациенты с гипогонадизмом обычно обращаются с жалобами на бесплодие, эректильную дисфункцию, снижение либидо или задержку пубертата. Тщательный сбор анамнеза и физикальное обследование помогают поставить правильный диагноз. Для подтверждения диагноза необходимо лабораторное обследование. При необходимости проводят дополнительные исследования: остеоденситометрию, МРТ гипофиза, генетическое обследование. При сборе анамнеза уточняют время начала заболевания и предшествующие ему события (например, вирусные инфекции или тяжелое хроническое заболевание). Головные боли и зрительные нарушения указывают на наличие объемного образования гипофиза, отсутствие обоняния — на синдром Каллмана. Патологические переломы и боли в костях свидетельствуют о наличии остеопороза. Анамнестическое данные о позднем начале пуберта та, оперативных вмешательствах (например, орхидопексия), медикаментозном лечении (например, гормональная терапия) имеют большое значение, так же как и наследственный анамнез (случаи позднего пубертата, гипогонадизма в семье), и помогают в постановке диагноза. Внимательный расспрос пациента относительно его сексуаль ной жизни обязателен. Несмотря на то что врачу часто кажется не удобным задавать вопросы относительно интимной стороны жизни, пациенты, как правило, охотно обсуждают эту тему в надежде получить помощь. Поэтому стоит расспросить о частоте сексу альных контактов, либидо, наличии спонтанных утренних эрекций и удовлетворенности своей половой жизнью. Измерение АД и окружности талии (в норме менее 94 см) являются обязательной частью физикального обследования. При осмотре оцениваются пропорции тела (евнухоидное телосложение), распределение подкожной жировой клетчатки (по женскому типу, абдоминальное ожирение), признаки вирилизации (половое оволосение, характер роста волос на лобке, развитие мышечной массы), наличие гинекомастии. При осмотре наружных половых органов оценивают расположение отверстия уретры, при гипоспадии и эписпадии можно заподозрить нарушение половой дифференцировки. Длина полового члена в норме составляет около 6 см и около 3 см в окружности. При пальпации яичек оценивают их размер и консистенцию, при наличии дополнительных образований или боли при пальпации мошонки проводится УЗИ. Наличие флюктуации при пальпации Таблица 17.8 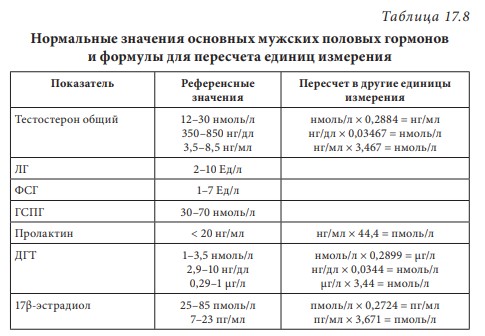 18Нормальные значения основных мужских половых гормонов и формулы для пересчета единиц измерения указывает на гидроцеле. Варикоцеле и варикозное расширение вен семенного канатика чаще бывает слева. Уплотнение придатка яичка или семенного канатика может указывать на наличие сперматоцеле или перенесенного воспалительного процесса и должно быть подтверждено с помощью УЗИ. Также необходимо проводить пальпацию предстательной железы, оценку ее размеров и консистенции. Лабораторная диагностика. Минимальное лабораторное обследование включает в себя определение общего тестостерона, лютеинизирующего гормона и ФСГ. Уровень тестостерона позволяет оценить андрогенпродуцирующую активность яичка, лютеинизирующего гормона и ФСГ указывают на гипофизарную функцию. Не существует единого мнения относительно нижней границы нормы уровня общего тестостерона. Различными медицинскими сообществами предлагаются цифры в пределах 10–5 нмоль/л. Тем не менее большинством международных организаций принята нижняя граница нормы на уровне 12 нмоль/л (табл. 17.8). Повышенный уровень гонадотропинов указывает на первичный гипогонадизм, низкие уровни лютеинизирующего гормона и ФСГ в сочетании со снижением тестостерона свидетельствуют о вторичном гипогонадизме. Повышение лютеинизирующего гормона при нормальном уровне тестостерона, за исключением редких случаев резистентности к андрогенам, характерно для недостаточности функции клеток Лейдига. Повышение ФСГ указывает на повреждение сперматогенного эпителия. При сочетании повышенного ФСГ, маленьких по объему яичек (менее 6 мл) и азооспермии стоит подозревать синдром Клайнфельтера. При наличии азооспермии или олигозооспермии, нормальных по объему яичек и нормального ФСГ вероятна обструкция семявыносящих протоков. Тест с ГнРг используется для дифференциальной диагностики низкого и низко нормального уровня гонадотропинов, а также помогает разделить гипоталамический и гипофизарный гипогонадизм, конституциональную задержку пубертата и гипогонадотропный гипогонадизм. При проведении теста 100 μг ГнРг вводится внутривенно, при этом проводится забор крови на лютеинизирующий гормон и ФСГ исходно и через 45 мин после введения препарата. У здорового мужчины и при конституциональной задержке пубертата определяется 1,5–2-кратное повышение уровня лютеинизирующего гормона, при незначительном повышении ФСГ. Меньшее повышение уровня лютеинизирующего гормона свидетельствует о гипофизарной причине гипогонадизма. У взрослого мужчины с гипогонадизмом, возраст которого не позволяет подозревать конституциональную задержку пубертата, хороший прирост лютеинизирующего гормона может указывать на гипоталамический генез гипогонадизма. При возрастном андрогенном дефиците стоит оценивать не только общий, но и свободный тестостерон. Лабораторное определение свободного тестостерона не отличается высокой точностью, поэтому лучше рассчитывать свободный тестостерон самостоятельно. Для расчета необходимы уровень общего тестостерона и ГСПГ. Калькулятор доступен на сайте Международного общества по изучению старения мужчин (International Society for the Study of the Aging Male-ISSAM) (http://www.issam.ch/freetesto.htm). В норме уровень свободного тестостерона, рассчитанного по данному калькулятору, должен быть более 0,225 нг/дл (табл. 17.9). Прием пищи не влияет на уровень тестостерона, однако повышение липидов в сыворотке крови после еды сказывается на точ- Таблица 17.9  19Возможные варианты результатов гормонального анализа крови у мужчин с гипогонадизмом Резистентность к андрогенам, показана консультация генетика ности его лабораторного определения, поэтому анализ крови на гормоны лучше сдавать натощак. Стимуляционный тест с ХГЧ, который обладает биологической активностью, сходной с воздействием лютеинизирующего гормона, используется с целью дифференциальной диагностики между крипторхизмом и анорхизмом. В ходе теста определяют уровень тестостерона исходно и через 72 ч после внутримышечного введения 5000 Ед ХГЧ. Повышение тестостерона в 1,5–2 раза указывает на наличие тестикулярной ткани. При вторичном гипогонадизме или уровне общего тестостерона менее 8 нмоль/л показано определение пролактина. При повышении пролактина более чем в 2 раза необходимо исключить прием лекарственных препаратов, влияющих на уровень пролак тина (психотропные препараты, метоклопрамид и др.), а также оценить уровень макропролактина или измерить биологически активный пролактин. При исключении макропролактинемии и симптоматической гиперпролактинемии показано проведение МРТ гипофиза, оптимально, с контрастированием. При обнаружении объемного образования гипоталамо-гипофизарной области необходимо исключить вторичный гипотиреоз, вторичную надпочечниковую недостаточность, соматотропную недо статочность. Для лечения гиперпролактинемии используются препараты из группы дофаминомиметиков — бромокриптин, каберголин, квинаголид. Макроаденомы гипофиза в ряде случаев подлежат оперативному лечению. Если после нормализации уровня пролактина в течение 6 мес. сохраняется пониженный уровень тестостерона, показана заместительная терапия препаратами тестостерона. При наличии гинекомастии помимо пролактина необходимо определение 17β-эстрадиола. Повышение уровня эстрадиола встречается при следующих заболеваниях и состояниях: • новообразования (опухоли яичка из клеток Лейдига или клеток Сертоли); • первичный гипогонадизм; • пирроз печени; • гипертиреоз; • гормонпродуцирующие опухоли надпочечников; • ожирение; • синдром резистентности к андрогенам; • лекарственные препараты (эстрогены, антиандрогены, анти эстрогены, ХГЧ). Определение эстрадиола также показано молодым мужчинам с тяжелым остеопорозом для диагностики редких дефектов: дефи цита ароматазы и аномалий рецептора к эстрогенам. Для остальных пациентов с гипогонадизмом определение эстрадиола не нужно. При планировании заместительной терапии андрогенами мужчинам старше 45 лет определяют простат-специфический антиген и проводят пальцевое исследование предстательной железы или УЗИ предстательной железы. 17.5. Лечение гипогонадизма Лечение гипогонадизма показано всем мужчинам при уровне тестостерона менее 8 нмоль/л, в пределах 8–12 нмоль/л лечение назначается при наличии симптомов дефицита андрогенов. Как было сказано ранее, основной андроген в мужском организме — тестостерон, 5–7 г которого ежедневно вырабатываются в яичках здорового мужчины, именно поэтому цель лечения заключается в достижении и поддержании тестостерона на уровне нижней границы нормы, а также устранении симптомов и предотвращении отдаленных последствий андрогенного дефицита. В настоящее время наиболее распространена заместительная терапия препаратами тестостерона. Помимо этого, известна стимулирующая терапия препаратами ХГЧ, возможно сочетание обоих вариантов лечения. Тестостерон в системном кровотоке имеет очень короткий период полужизни и быстро инактивируется в печени, поэтому пероральные формы тестостерона, которые после всасывания в двенадцатиперстной кишке сразу попадают в портальную систему печени, эффективны только при применении в высоких дозах (более 200 мг), превышающих метаболические возможности печени. Именно поэтому предпочтительны парентеральные пути введения или использование химически модифицированных андрогенов (табл. 17.10). В истории заместительной терапии андрогенами использовались различные химические модификации молекулы тестостерона. Так, алкилирование по 17α-позиции (метилтестостерон, флуокси местерон) предотвращало быстрое разрушение препарата в печени. Однако эти средства обладали гепатотоксичностью и сегодня не используются. Эстерификация 17β-гидроксильной группы также продлевает период полужизни препарата, не обладая при этом гепатотоксичностью. Такая модификация повышает липофильность молекулы и позволяет вводить его внутримышечно в виде масляного раствора. Чем длиннее боковая алифатическая цепь, тем медленнее скорость всасывания препарата из места введения. Тем не менее после попадания в системный кровоток эфиры тестостерона (тестостерона пропионат, тестостерона ундеканоат, тестостерона энантат, Таблица 17.10 Препараты тестостерона для заместительной терапии 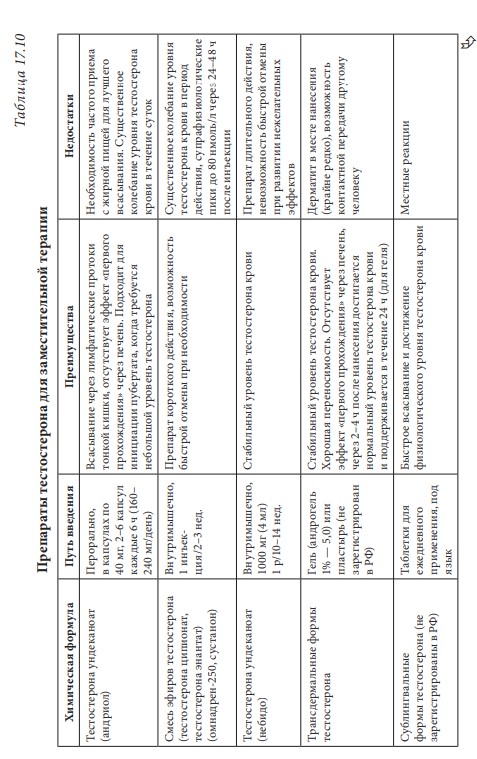 20  21тестостерона ципионат) имеют такой же короткий период полу жизни, как и сам тестостерон. В некоторых странах используется ДГТ в виде 2,5% геля Andractim. После местного нанесения в 1-й же день обнаруживается повышение ДГТ в сыворотке крови, при этом уровень тестостерона и 17β-эстрадиола остается неизменным, так как ДГТ не способен к конверсии в эти стероиды. В связи с этим ДГТ не обеспечивает всех эффектов тестостерона, в частности, не влияет на минеральную плотность костной ткани, поскольку этот эффект обеспечивается эстрадиолом. ДГТ не применяется для заместительной терапии мужского гипогонадизма. Основное показание для применения геля ДГТ: местное лечение при наличии маленького полового члена (микропенис). Реже применяется стимулирующая терапия препаратами хорионического гонадотропина (хорионический гонадотропин, хора гон, прегнил). Цель ее заключается в стимуляции сперматогенеза и синтеза эндогенного тестостерона, ХГЧ обладает активностью лютеинизирующего гормона и оказывает эффективное воздействие на клетки Лейдига. Данная терапия абсолютно неэффективна при первичном гипогонадизме, который обусловлен дефицитом или недостаточной функцией клеток Лейдига. При вторичном гипогонадизме терапия препаратами ХГЧ способствует восстановлению сперматогене за. Дополнительно для стимуляции сперматогенеза применяются препараты ФСГ (менопаузальный гонадотропин, рекомбинантный ФСГ) в дозе 150 МЕ 3 р/нед. внутримышечно. Также стимулирующая терапия подходит мужчинам с гипогонадизмом в рамках метаболического синдрома или возрастным дефицитом андрогенов, планирующих беременность супруги. Применяются 2 режима терапии препаратами ХГЧ: по 1500 Ед 2 р/нед. или по 5000 Ед 1 р/нед. внутримышечно. Помимо уровня тестостерона данная терапия требует мониторинга эстрадиола. Противопоказания к заместительной терапии андрогенами. Подтвержденный диагноз рака предстательной железы считается абсолютным противопоказанием к терапии андрогенами. Перед началом лечения у всех мужчин старше 45 лет необходимо определение простат-специфического антигена и проведение пальцевого ректального исследования или УЗИ предстательной железы. У мужчин после успешного лечения локальных форм рака предстательной железы (до лечения: менее 8 баллов по шкале Gleason, Т1-2, простат-специфический антиген менее 10 нг/мл) вопрос о назначе нии терапии андрогенами решают строго индивидуально не менее чем через год после лечения. Рак грудной железы также считается абсолютным противопоказанием к назначению андрогенов. Андрогены ароматизируются в эстрогены и при наличии эстрогеновых рецепторов в клетках опухоли применение андрогенов потенциирует рост карциномы. Гинекомастия не относится к противопоказанию к назначению андрогенов. При наличии повышенного уровня эстрадиола и, соответственно, высокой активности ароматазы в жировой ткани, эффективно применение препаратов из группы ингибиторов ароматазы в малых дозах (тамоксифен, анастрозол), хотя данное показание не отражено в инструкции к данным препаратам. Терапия тестостероном не приводит к развитию сердечно-сосудистых заболеваний de novo. У пациентов с существующими сердечно-сосудистыми заболеваниями необходим контроль гемоглобина и гематокрита перед началом терапии и во время нее. Пациентам с эритроцитозом и тяжелой сердечной недостаточностью III–IV стадии по NYHA лечение андрогенами не показано. Несмотря на периодически возникающие публикации, не существует корреляции между терапией тестостероном и синдромом обструктивного апноэ во сне. Терапия андрогенами не приводит к возникновению или прогрессированию данного заболевания. Побочное действие терапии андрогенами. Эта терапия отличается высокой безопасностью и незначительным количеством побочных эффектов. Поскольку андрогены ответственны за активность сальных желез, в начале их применения у мужчин с длительным анамнезом гипогонадизма возможно появление акне. Подавляя продукцию гонадотропинов, все существующие формы препаратов тестостерона угнетают сперматогенез. Данный эффект полностью обратим в течение 3 мес. после прекращения терапии. Повышение гематокрита более 50% и гемоглобина более характерно для инъекционных форм и при появлении данного по- Таблица 17.11 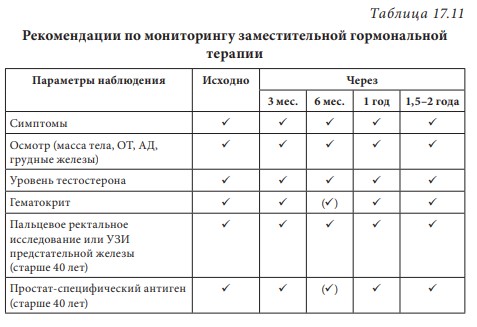 22Рекомендации по мониторингу заместительной гормональной терапии бочного эффекта возможно назначение трансдермальных форм тестостерона. Динамическое наблюдение за пациентами, получающими терапию андрогенами. Пациенты, получающие заместительную терапию андрогенами или стимулирующую терапию препаратами ХГЧ, должны находиться под наблюдением лечащего врача. Влияние терапии на либидо отмечают уже после 3 нед. терапии, улучшение эректильной функции занимает до 6 мес. Повышение настроения, влияние на качество жизни определяется в среднем через 1 мес. лечения, для развития максимального эффекта может потребоваться больше времени. План динамического наблюдения представлен в табл. 17.11. Литература Моргунов Л.Ю. Дефицит андрогенов и ассоциированная с ним патология в общесоматической практике: Дис. … докт. мед. наук. — 2008. — 250 с. Alexander J.M., Swerdloff R.S., Wang C. Androgen-behav ior correlations in hypogonadal men and eugonadal men // Horm. Behavior. — 1997. — V. 31. — P. 110–119. Allan C.A., McLachlan R.I. Androgens and obesity // Curr. Opin. Endo crinol. Diabetes. Obes. — 2010. — V. 17. — P. 224–232. Bajos N., Wellings K., Laborde C. et al. Group. Sexuality and obesity, a gen der perspective: results from French national random probability survey of sex ual behaviours // B.M.J. — 2010. — V. 340. — P. 2573. Bal K., Oder M., Sahin A.S. et al. Prevalence of metabolic syndrome and its association with erectile dysfunction among urologic patients: metabolic back grounds of erectile dysfunction // Urology. — 2007. — V. 69. — P. 356–360. Bhasin S., Buckwater J. Testosterone supplementation in older men: a ra tional idea whose time has not come yet // J. Androl. — 2001. — V. 22. — P. 718–731. Boyanov M.A., Boneva Z., Christov V. Testosterone Supplementation in men with type 2 diabetes, visceral obesity and partial androgen defi ciency // Aging Male. — 2003. — V. 6. — P. 1–7. Brand J.S., van der Tweel I., Grobbee D.E. et al. Testosterone, sex hormonebind ing globulin and the metabolic syndrome: a systematic review and metaanalysis of observational studies // J. Epidemiol. — 2011. — V. 40. — P. 189–207. Brinkman A.O., Jenster G., Kuiper G. Structure and function of the human androgen receptor. Spermatogenesis, Fertilisation, Contraception. — Springer Verlag, 1992. — P. 97–122. Bross B., Javanbahkit M., Bhasin S. Anabolic interventions for agingasso ciated sarcopenia // J. Clin. Endocr. Metab. — 1999. — V. 84. — P. 3420–3430. Corona G., Mannucci E., Petrone L. et al. Association of hypogonadism and type II diabetes in men attending an outpatient erectile dysfunction clinic // J. Impot. Res. — 2006. — V. 18. — P. 190–197. Corona G., Monami M., Rastrelli G. et al. Type 2 diabetes mellitus and tes tosterone: a meta-analysis study // J. Androl. — 2010. De Berardis G., Franciosi M., Belfi glio M. et al. Erectile dysfunction and quality of life in type 2 diabetic patients: a serious problem too oft en over looked // Diab. Care. — 2002. — V. 25. — P. 284–291. De Kester D.M., McLachan R.I., Brown L. Control of spermatogenesisby fol licle stimulating hormone and testosterone // Bailiere’s Clin Endocr Metab. — 1992. — V. 6. — P. 335–354. Ding E.L., Song Y., Manson J.E. et al. Sex hormone-binding globulin and risk of type 2 diabetes in women and men // New Engl. J. Med. — 2009. — V. 361. — P. 1152–1163. Dohle G.R., Arver S., Bettocchi C. et al. Guidelines on male hypogonadism // Male Hypogonadism. — 2012. — P. 4–28. Faris J.E., Smith M.R. Metabolic sequelae associated with androgen depri vation therapy for prostate cancer // Curr. Opin. Endocrinol. Diabet. Obes. — 2010. — V. 17. — P. 240–246. Fedele D., Bortolotti A., Coscelli C. et al. Erectile dysfunction in type 1 and type 2 diabetics in Italy. On behalf of Gruppo Italiano Studio Defi cit Erettile nei Diabetici // J. Epidemiol. — 2000. — V. 29. — P. 524–531. Feldman H.A. Age trend in the levels of serum testosterone and other hor mones in the middle-aged men: longitudinal results from Massachusetts Male Aging Study // J. Clin. Endocrinol. Metab. — 2002. — V. 87. — P. 589–598. Gray A., Berlin J., McKinlay J. An examination of research design eff ect on the association of testosterone and male aging: results of meta-analis // J. Clin. Epidemiol. — 1991. — V. 44. — P. 671 684. Guzik T.J., Mangalat D., Korbut R. Adipocytokines: novel link between in fl ammation and vascular function? // J. Physiol. Pharmacol. — 2006. — V. 57. — P. 505–528. Harman S.M, Metter E.J, Tobin J. Longitudinal eff ects of aging on serum total and free testosterone levels in healthy males // J. Clin. Endocr. Metab. — 2001. — V. 86. — P. 724–731. Heinemann L., Zimmermann T., Vermeulen A. A new aging males’ symp toms rating scale // Aging. Male. — 2001. — V. 2. — P. 105–114. Jain P., Rademaker A., McVary K. Testosterone supplementation for erectile dysfunction: results of meta-analisis // J. Urol. — 2001. — V. 164. — P. 371–375. Jegou B. Th e Sertoli Cell Bailiere’s // Clin. Endocr. Metab. — 1992. — V. 6. — P. 273–311. Jockenovel F., Gerhardts S. Erkrankungen von Hypotalamus und Hypophy se. — Bremen: Uni-Med Verlag, 2002. Kalinchenko S., Kozlov G., Gontcharov N. Oral testosterone undecanoate re verses erectile dysfunction associated with diabetes mellitus in patients failing on sildenafi l citrate alone // Aging. Male. — 2003. — V. 6. — P. 94–99. Kapoor D., Clarke S., Channer K.S. et al. Erectile dysfunction is associated with low bioactive testosterone levels and visceral adiposity in men with type 2 diabetes // J. Androl. — 2007. — V. 30. — P. 500–507. Khat K.T., Barret-Connor E. Lower endogenous androgens predict central adiposity in men // Ann. Epidemiol. — 1992. — V. 2. — P. 675–682. King R. Eff ect of steroid hormons and related compound on gene transcrip tion // Clin. Endocrinol. — 1992. — V. 36. — P. 1–14. Kupelian V., Shabsigh R., Araujo A.B. et al. Erectile dysfunction as a pre dictor of the metabolic syndrome in aging men: results from the Massachusetts Male Aging Study // J. Urol. — 2006. — V. 176. — P. 222–226. Lakshman K.M., Bhasin S., Araujo A.B. Sex hormone-binding globulin as an independent predictor of incident type 2 diabetes mellitus in men // J. Geron tol. Biol. Sci Med. Sci. — 2010. — V. 65. — P. 503–509. Lapauw B., Ouwens M., Hart L.M. et al. Sex steroids aff ect triglyceride handling, glucose-dependent insulinotropic polypeptide, and insulin sensitivity: a 1-week randomized clinical trial in healthy young men // Diab. Care. — 2010. — V. 33. — P. 1831–1833. Larsen S.H., Wagner G., Heitmann B.L. Sexual function and obesity // J. Obes. (Lond.). — 2007. — V. 31. — P. 1189–1198. Lindau S.T., Tang H., Gomero A. et al. Sexuality among middle-aged and older adults with diagnosed and undiagnosed diabetes: a national, population based study // Diab. Care. — 2010. — V. 33. — P. 2202–2210. Loves S., Ruinemans-Koerts J., de Boer H. Letrozole once a week normaliz es serum testosterone in obesity-related male hypogonadism // Europ. J. Endo crinol. — 2008. — V. 158. — P. 741–747. MacDonald A.A., Herbison G.P., Showell M. et al. Th e impact of body mass in dex on semen parameters and reproductive hormones in human males: a systematic review with meta-analysis // Hum. Reprod. Update. — 2010. — V. 16. — P. 293–311. Mitchell R., Hollis S., Rothwell C. Age-related changes in the pituitarytestic ular axis in normal men; low testosterone results from decreased bioactive LH drive // Clin. Endocrinol. — 1995. — V. 42. — P. 501–507. Moffat A., Zonderman A., Metter E. Longitudinal assessment of serum free testosterone concentration predicts memory performance and cognitive status in elderly men // J. Clin. Endocr. Metab. — 2002. — V. 87. — P. 5001–5007. Morgentaler A. Male impotence // Lancet. — 1999. — V. 354. — P. 1713–1718. Pitteloud N., Hardin M., Dwyer A.A. et al. Increasing insulin resistance is associated with a decrease in Leydig cell testosterone secretion in men // J. Clin. Endocrinol. Metab. — 2005. — V. 90. — P. 2636–2641. Ringe J., Dorst A. Osteoporose bei Mannern // Dtsch. Med. Wschr. — 1994. — Bd. 119. — S. 943–947. Rosen R.C., Wing R.R., Schneider S. et al. Erectile dysfunction in type 2 dia betic men: relationship to exercise fi tness and cardiovascular risk factors in the Look AHEAD trial // J. Sex. Med. — 2009. — V. 6. — P. 1414–1422. Rosner W. Plasma steroid-binding proteins. Endocr.Metab // Clin. North Amer. — 1991. — V. 20. — P. 687–720. Schaison G., Cousinet B. Percutaneous dihydrotestosterone treat ment. Testosterone — action, defi ciency, substitution. — Springer. Verlag, 1998. — P. 423–436. Shanzer W. Metabolism of anabolic androgenic steroids // Clin. Chem. — 1996. — V. 42. — P. 1001–1020. Traish A.M., Feeley R.J., Guay A. Mechanisms of obesity and related pathol ogies: androgen defi ciency and endothelial dysfunction may be the link between obesity and erectile dysfunction // FEBS J. — 2009. — V. 276. — P. 5755–5767. Traish A.M., Goldstein I., Kim N.N. Testosterone and erectile function: from basic research to a new clinical paradigm for managingmen with androgen in suffi ciency and erectile dysfunction // Eur. Urol. — 2007. — V. 52. — P. 54–70. Yialamas M.A., Dwyer A.A., Hanley E. et al. Acute sex steroid withdraw al reduces insulin sensitivity in healthy men with idiopathic hypogonadotropic hypogonadism // J. Clin. Endocrinol. Metab. — 2007. — V. 92. — P. 4254–4259. Wieacker P.F., Knoke I., Jacubiczka S. Clinical and molec ular aspects of androgen receptor defects // Exp. Clin. Endocr. Diabetes. — 1998. — V. 106. — P. 446–452. Wu F.C.V. Testicular steroidogenesis and androgen use and abuse // Bail iere’s Clin. Endocr. Metab. — 1992. — V. 6. — P. 373–403. Wu F.C., Tajar A., Beynon J.M. et al. Identifi cation of late-onset hypo gonadism in middle-aged and elderly men // New Engl. J. Med. — 2010. — V. 363. — P. 123–135. |
|
|
|
